乙酸
| 乙酸 | |||
|---|---|---|---|
| |||
| |||
| IUPAC名 Acetic acid | |||
| 系统名 Ethanoic acid | |||
| 别名 | 醋酸 | ||
| 识别 | |||
| 缩写 | HOAc | ||
| CAS号 | 64-19-7 | ||
| PubChem | 176 | ||
| ChemSpider | 171 | ||
| SMILES |
| ||
| Beilstein | 506007 | ||
| Gmelin | 1380 | ||
| 3DMet | B00009 | ||
| UN编号 | 2789 | ||
| EINECS | 200-580-7 | ||
| ChEBI | 15366 | ||
| RTECS | AF1225000 | ||
| DrugBank | DB03166 | ||
| KEGG | D00010 | ||
| MeSH | Acetic+acid | ||
| IUPHAR配体 | 1058 | ||
| 性质 | |||
| 化学式 | CH3COOH | ||
| 摩尔质量 | 60.05 g·mol⁻¹ | ||
| 外观 | 无色液体或晶体 | ||
| 密度 | 1.049 g·cm−3 (l) 1.266 g·cm−3 (s) | ||
| 熔点 | 16-17 °C(289-290 K)(289.6 K, 61.6 °F) | ||
| 沸点 | 118-119 °C(391-392 K)(391.2 K, 244.5 °F) | ||
| 溶解性(水) | 混溶 | ||
| 溶解性 | 乙醇、丙酮中完全可溶,甲苯、己烷中完全可溶,二硫化碳中几乎不溶 | ||
| log P | -0.322 | ||
| pKa | 4.76 (25℃) | ||
| pKb | 9.198 | ||
| 黏度 | 1.22 mPa·s(25℃) | ||
| 结构 | |||
| 偶极矩 | 1.74 D (g) | ||
| 热力学 | |||
| ΔfHm⦵298K | -483.5 kJ/mol | ||
| S⦵298K | 158.0 J/mol/K | ||
| 热容 | 123.1 J/mol/K | ||
| 危险性 | |||
| 警示术语 | R:R10-R35 | ||
| 安全术语 | S:S1/2-S23-S26-S45 | ||
| 主要危害 | 有腐蚀性 有刺激性 | ||
| NFPA 704 | |||
| 闪点 | 40℃ | ||
| 自燃温度 | 400 °C | ||
| 致死量或浓度: | |||
LD50(中位剂量)
|
3.31 g·kg-1, 大鼠 (口服) | ||
| 相关物质 | |||
| 相关羧酸 | 甲酸、丙酸、丁酸 | ||
| 相关化学品 | 乙酰胺、乙酸乙酯、乙酰氯、乙酸酐、乙腈、乙醛、乙醇、硫代乙酸、乙酰胆碱、乙酰胆碱酯酶 | ||
| 附加数据页 | |||
| 结构和属性 | 折射率、介电系数等 | ||
| 热力学数据 | 相变数据、固、液、气性质 | ||
| 光谱数据 | UV-Vis、IR、NMR、MS等 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
乙酸(英语:ethanoic acid)又称醋酸(英语:acetic acid),化学式为CH3COOH,是一种有机一元酸和短链饱和脂肪酸,为食醋酸味及刺激性气味的来源。近乎无水的纯乙酸(含水量1%以下)称为“冰醋酸”,为无色的吸湿性晶体,凝固点为16~17℃(62℉)。尽管乙酸是一种弱酸,但是它具有腐蚀性,其蒸汽对眼和鼻有刺激性作用,闻起来有一股刺鼻的酸臭味。
乙酸是第二简单的羧酸(仅次于甲酸),其分子由一个甲基一个羧基构成。乙酸是一种重要的化学试剂;在化学工业中,它被用来制造聚对苯二甲酸乙二酯,后者即饮料瓶的主要成分。乙酸也被用来制造电影胶片所需要的醋酸纤维素和木材用胶粘剂中的聚乙酸乙烯酯,以及很多合成纤维和织物。家庭中,乙酸稀溶液常被用作除垢剂。食品工业方面,乙酸是欧盟食品添加剂列表规定的一种酸度调节剂,编号为E260。
每年世界范围内的乙酸需求量在650万吨左右。其中大约150万吨是循环再利用的,剩下的500万吨通过石化原料直接制取或通过生物发酵制取。
命名
[编辑]乙酸(英语:acetic acid)既是常用名也是国际化联(IUPAC)推荐的学名[1],来自拉丁文中的表示醋的词“acetum”。在中文世界中亦使用俗名醋酸。无水乙酸在略低于室温的温度下(16.7℃),能够转化为一种具有腐蚀性的冰状晶体,故常称几乎不含水的乙酸为冰醋酸(英语:glacial acetic acid)[2]。
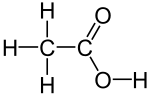
乙酸的实验式(最简式)为CH
2O,分子式为C
2H
4O
2,结构简式常写为CH
3–COOH或CH
3COOH。乙酸失去一当量的氢正离子(H+
)后形成的离子称为乙酸根离子(CH
3COO−
)。乙酸最常用的缩写是AcOH或HOAc,其中Ac代表了乙酸中的乙酰基(CH
3CO)[3]。在书写酸碱中和反应时也可以用HAc表示乙酸,其中Ac代表了乙酸根离子[4]。
研究史
[编辑]早期研究
[编辑]
乙酸发酵细菌(醋酸杆菌)在世界的各个角落均有分布,故每个民族在酿酒实践中均不可避免地会发现醋——它是酒精饮料暴露于空气后的自然产物。在中国就有杜康的儿子黑塔因酿酒时间过长得到醋的说法[5]。乙酸在化学中的运用可以追溯到很古老的年代。早在公元前3世纪,古希腊哲学家泰奥弗拉斯托斯就详细描述了醋是如何与金属发生反应生成美术上要用的颜料的,例如白铅(碳酸铅)和铜绿(含乙酸铜之铜化合物混合物)。[6]古罗马人发现将发酸的酒放在铅制容器中煮沸能得到一种高甜度的“糖浆”,称之为“sapa”;其富含一种有甜味的物质铅糖,即乙酸铅。饮用该种“糖浆”导致诸多罗马贵族罹患铅中毒。8世纪时,波斯炼金术士贾比尔用蒸馏法浓缩了醋中的乙酸。[7]
文艺复兴时期的炼金术士通过重金属乙酸盐的干馏制得了冰醋酸。16世纪德国炼金术士安德烈亚斯·利巴菲乌斯就描述了这种方法,并比较了由此法制备的冰醋酸和醋中提取的酸的性质差异。水的存在令乙酸的性质巨变,以至于在几个世纪里,化学家们都认为冰醋酸和醋中的酸是截然不同的物质。法国化学家拉瓦锡甚至猜测冰醋酸是醋中酸的氧化产物。1797年,法国化学家皮埃尔·阿代通过实验证明两者的差异不过是含水量不同而已。[6][8][9]
化学合成与表征
[编辑]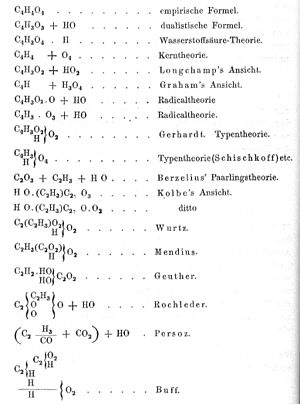
1815年,瑞典化学家约恩斯·贝尔塞柳斯通过对乙酸铅的化学分析,依当时的原子量系统(=6,=8)给出了乙酸的“化学式”。贝尔塞柳斯利用电化二元理论将乙酸解释为碳氢“自由基”之“三氧化物”,乙酸盐则被他解释为“带负电性”的乙酸和“带正电性”的碱的“加成产物”:例如,乙酸钾为。[10][11]
1838年,法国化学家让-巴蒂斯特·杜马将乙酸与氯气反应,制得了三氯乙酸;他发现三氯乙酸与乙酸的化学性质高度相似。1842年,杜马的助手,法国化学家路易·梅森发现三氯乙酸还原后又重新生成乙酸。鉴于根据电化二元论提出的乙酸结构式无法解释上述实验现象,贝尔塞柳斯转而认为乙酸由“甲基”和“草酸基”结合而成,即。[10][11]
1843年至1847年,德国化学家阿道夫·威廉·赫尔曼·科尔贝对有机氯化物展开了研究。在研究中,科尔贝证实以无机物乃至单质为原料可以合成乙酸[6]。合成路线包括以下步骤:碳单质与二硫化铁反应生成二硫化碳;氯化二硫化碳得四氯化碳;接着将制得的四氯化碳高温裂解,生成四氯乙烯;进而将制得的四氯乙烯在日光照射下用氯水处理,得到三氯乙酸;最后一步电解还原三氯乙酸,即得乙酸。该路线的每一步反应均被科尔贝本人或早前其他人的工作证实为可行。这一结果有力地驳斥了“有机物需藉‘生命力’(拉丁语:vis vitalis)方能制造”之理论;科尔贝称其揭示了“乙酸,这种到目前为止仅被认为是有机质氧化产物的物质,可以轻而易举地‘合成’(德语:Synthese)出来”的有趣事实。[12][13]此乃“合成”一词首度见诸有机化学文献。[11][14]
1847年,科尔贝与爱德华·弗兰克兰发现乙腈碱水解可制得乙酸。当时已知氰水解的产物为草酸;科尔贝据此断定乙酸等脂肪族羧酸中存在“草酸基”。1849年,科尔贝通过分析乙酸盐电解产物,进一步证实了贝尔塞柳斯早前提出的乙酸“结构式”。[12][14]
另一方面,早在1843年法国化学家查尔斯·弗雷德里克·格哈特就发现,按照当时的约定书写的有机反应式中,水这样的无机物总是成对出现;他据此推测有机物的式量实为当时公认值的一半。1851年,英国化学家亚历山大·威廉·威廉姆逊依据其研究醇类的结果,指出乙酸分子是水分子中一个氢为所取代的产物,而非如贝尔塞柳斯所预言的那样本身含有一当量的水;他同时预言了水分子中两个氢都被取代的产物——乙酸酐的存在。1852年,格哈特制备了乙酸酐,还制备了乙酸-苯甲酸酐这样的混酐,从而证实了威廉姆逊提出的结构。尽管如此,由于原子量系统和符号系统尚未统一,在这一时期的文献中,乙酸的化学式仍然五花八门。德国化学家凯库勒的著作中摘录的乙酸化学式竟有十九种之多(如左图所示)。直至1860年卡尔斯鲁厄会议召开,与会化学家们普遍接受斯坦尼斯劳·坎尼扎罗“应遵循阿伏加德罗的设想,以气体密度定分子量”的意见后,情况才有所改观。[10][11][15]
工业生产
[编辑]19世纪前,人类制造的绝大部分乙酸都是以食醋的形式,通过糖类发酵生产的。19世纪后半叶出现了木材干馏工艺,木焦油(含有约5%至8%的乙酸)成为了食醋之外乙酸的另一来源;1910年时,大部分的冰醋酸提取自木焦油。该工艺先以氢氧化钙处理木焦油,从中分离出乙酸钙;用硫酸酸化乙酸钙即得乙酸。这一时期,德国年生产万余吨冰醋酸,其中30%被用来制造靛青染料。[16][17]20世纪10年代,乙醛氧化工艺投入生产,拉开了以化学合成方法工业生产乙酸的序幕。20世纪50至70年代,丁烷-石脑油氧化工艺逐步投产,并因原料石脑油的低廉成本而成为了乙酸生产的重要工艺;1973年时,40%的乙酸以此工艺生产。1963年,巴斯夫公司开发了以钴盐为催化剂的甲醇羰基化工艺;孟山都公司则在1968年发明了铑基催化剂体系下的甲醇羰基化工艺——孟山都工艺,并在20世纪70年代将其商业化。甲醇羰基化工艺问世后,迅速取诸氧化工艺而代之,成为今日乙酸工业生产的主流工艺。[6][18]
物理性质
[编辑]
乙酸在常温常压下是一种有强烈刺激性酸味的无色液体,其凝固点为16.6 °C(289.8 K),沸点117.9 °C(391.0 K),相对密度1.05。不纯的乙酸通常含水,有时也会含有少量的乙醛、乙酸酐、甲酸等其他杂质。纯乙酸在略低于室温时会凝结成冰状晶体,水-乙酸体系的共晶点温度则低达-26℃。由于水的存在会显著降低乙酸的凝固点,可通过测凝固点来推算其纯度。[6][19]
结构
[编辑]
乙酸晶体属正交晶系,空间群Pna21。X射线衍射结果表明,在乙酸晶体内部,乙酸分子通过氢键相互缔合形成长链;分子内两个碳原子与两个氧原子共平面,相邻分子间则为异面关系。[20] 气相中,乙酸分子则通过氢键两两缔合成中心对称的环状二聚体(如右图所示)。[18]该种二聚体稳定性较高,解离焓约为:[21]
二聚体的存在令乙酸蒸汽的密度远大于根据其分子量计算得到的值。其它低级羧酸(如甲酸)在固相和气相中也通过氢键形成结构类似的缔合物。[6][20]至于液相中乙酸的超分子结构,目前学界尚缺乏共识:一些理论计算和实验结果表明乙酸主要以二聚体的形式存在,另一些却表明乙酸主要以长分子链的形式存在,还有一些则认为单体、寡聚体和分子链并存。[22]
溶剂性质
[编辑]液态乙酸是亲水质子性极性溶剂。由于缔合结构的存在,液态乙酸的极性并不强,其相对介电常数只有6.2。依相似相溶原理,乙酸并非强极性溶质的良好溶剂,但实验结果表明部分强极性溶质(如无机盐)仍或多或少可溶于乙酸:硝酸锂、硝酸钙、硝酸铵易溶于乙酸,而卤化钠、卤化钾、卤化铵仅微溶于乙酸。液态乙酸较弱的极化能力也使得分散于乙酸中的离子间的具有较强的相互作用。这导致一些在水溶液中完全电离的强电解质在乙酸溶液中仅能部分电离,从而部分甚至大部分以分子或离子对的形式存在。因此,一些在水溶液中被“拉平”的强酸在乙酸溶液中得以区分出强弱;乙酸溶液中盐效应亦十分显著。[23][24][25][26][27]对于有机溶质而言,乙酸则是一种优良的溶剂。此外,乙酸自身与水、乙醇、乙醚等其它溶剂混溶,在多数有机溶剂中可溶,但难溶于二硫化碳。[19][28]
化学性质
[编辑]酸碱性
[编辑]乙酸是一元羧酸。其羧基氢能够电离为氢离子(质子),从而呈现酸性。乙酸在水溶液中是弱酸,酸度系数pKa=4.75(25℃)[6],略强于碳酸;浓度为0.1mol/L的乙酸溶液中,仅有约1%的乙酸分子电离[29]。
乙酸具有酸的通性,可与碱金属/碱土金属氢氧化物发生酸碱中和反应,也能与碳酸盐、碳酸氢盐发生反应;产物均为乙酸盐:[6][19]
乙酸的碱性极其微弱。当且仅当遇到超强酸时,乙酸才能充当质子受体。 [6]
有机反应
[编辑]
乙酸具有羧酸的通性,能参与诸多有机反应:乙酸可与五氯化磷或氯化亚砜反应,生成乙酰氯;可在浓硫酸存在下与醇类发生酯化反应,生成乙酸酯;还可在脱水剂(如五氧化二磷)的作用下脱水生成乙酸酐:[19]
乙酸可被氢化铝锂还原,产物为乙醇。此外,乙酸含有α氢,可在赤磷存在下与卤素单质发生α-卤代反应,生成单卤代、双卤代乃至三卤代乙酸:[19]
440℃的高温下,乙酸发生热裂解,反应途径有两条:一是生成甲烷和二氧化碳;二是生成乙烯酮和水。在伽玛射线或电子束的作用下,乙酸也会分解成上列产物。电子回旋共振可将乙酸直接分解成碳单质,并以金刚石薄膜的形式将之沉积于器壁上。[6]
鉴别
[编辑]乙酸可与三氯化铁发生显色反应,生成深红色的产物乙酸铁。该反应非常灵敏,既可以用于乙酸的定性分析,也可借由比色法用于乙酸的定量分析[30]。将乙酸与氨水和硝酸镧溶液混合后会得到深蓝色的溶液,该显色反应亦能用于乙酸的定性分析。此外,乙酸也可通过酯化反应来鉴别:将试样与乙醇和浓硫酸混合后煮沸,若试样为乙酸,则会生成具有芳香气味的产物乙酸乙酯。[31]
生物化学
[编辑]乙酸中的乙酰基,是生物化学中所有生命的基础。当它与辅酶A结合后,就成为了碳水化合物和脂肪新陈代谢的中心。然而,乙酸在细胞中的浓度是被严格控制在一个很低的范围内,避免使得细胞质的pH发生破坏性的改变。与其它长链羧酸不同,乙酸并不存在于甘油三酸脂中。但是,人造含乙酸的甘油三酸脂,又叫甘油醋酸酯(三乙酸甘油酯),则是一种重要的食品添加剂,也被用来制造化妆品和局部性药物。
乙酸由一些特定的细菌生产或分泌。值得注意的是醋菌类梭菌属的丙酮丁醇梭杆菌,这个细菌广泛存在于全世界的食物、水和土壤之中。在水果或其他食物腐败时,醋酸也会自然生成。乙酸也是包括人类在内的所有灵长类生物的阴道润滑液的一个组成部分,被当作一个温和的抗菌剂[32]。在甲烷菌的作用下,乙酸也可以歧化分解产生甲烷和二氧化碳[33][34]。
制备
[编辑]
乙酸的制备可以通过人工合成和细菌发酵两种方法。75%的化工用乙酸是通过甲醇的羰基化制备。现在,生物合成法,即利用细菌发酵,仅占整个世界产量的10%,但是仍然是生产醋的最重要的方法,因为很多国家的食品安全法规规定食物中的醋必须是由生物制备的。其他制备方式有:甲酸甲酯异构法、水煤气合成法、气相乙烯或乙醇氧化法。[35]
整个世界生产的纯乙酸每年大概有500万吨,其中一半是由美国生产的。欧洲现在的产量大约是每年100万吨,但是在不断减少。日本每年也要生产70万吨纯乙酸。每年世界消耗量为650万吨,除了上面的500万吨,剩下的150万吨都是回收利用的[36][37] 。
发酵法
[编辑]有氧发酵
[编辑]在人类历史中,以醋的形式存在的乙酸,一直是用醋杆菌属细菌制备。在氧气充足的情况下,这些细菌能够从含有酒精的食物中生产出乙酸。通常使用的是苹果酒或葡萄酒混合谷物、麦芽、米或马铃薯捣碎后发酵。有这些细菌达到的化学方程式为:
做法是将醋菌属的细菌接种于稀释后的酒精溶液并保持一定温度,放置于一个通风的位置,在几个月内就能够变为醋。工业生产醋的方法通过提供氧气使得此过程加快。
现在商业化生产所用方法其中之一被称为“快速方法”或“德国方法”,因为首次成功是在1823年的德国。此方法中,发酵是在一个塞满了木屑或木炭的塔中进行。含有酒精的原料从塔的上方滴入,新鲜空气从他的下方自然进入或强制对流。改进后的空气供应使得此过程能够在几个星期内完成,大大缩短了制醋的时间。
现在的大部分醋是通过液态的细菌培养基制备的,由Otto Hromatka和Heinrich Ebner在1949年首次提出。在此方法中,酒精在持续的搅拌中发酵为乙酸,空气通过气泡的形式被充入溶液。通过这个方法,含乙酸15%的醋能够在两至三天制备完成。
无氧发酵
[编辑]部分厌氧细菌,包括梭菌属的部分成员,能够将糖类直接转化为乙酸而不需要乙醇作为中间体。总体反应方程式如下:
- C6H12O6 → 3CH3COOH
更令工业化学感兴趣的是,许多细菌能够从仅含单碳的化合物中生产乙酸,例如甲醇,一氧化碳或二氧化碳与氢气的混合物。
梭菌属因为有能够直接使用糖类的能力,减少了成本,这意味着这些细菌有比醋菌属细菌的乙醇氧化法生产乙酸更有效率的潜力。然而,梭菌属细菌的耐酸性不及醋菌属细菌。耐酸性最大的梭菌属细菌也只能生产不到10%的乙酸,而有的醋酸菌能够生产20%的乙酸。到现在为止,使用醋酸属细菌制醋仍然比使用梭菌属细菌制备后浓缩更经济。所以,尽管梭菌属的细菌早在1940年就已经被发现,但它的工业应用仍然被限制在一个狭小的范围。
甲醇羰基化法
[编辑]大部分乙酸是通过甲醇羰基化合成的。此反应中,甲醇和一氧化碳反应生成乙酸,方程式如下
这个过程是以碘代甲烷为中间体,分三个步骤完成,并且需要一个一般由多种金属构成的催化剂(第二步中)
- (2) CH3I + CO → CH3COI
- (3) CH3COI + H2O → CH3COOH + HI
通过控制反应条件,也可以通过同样的反应生成乙酸酐。因为一氧化碳和甲醇均是常用的化工原料,所以甲基羰基化一直以来备受青睐。早在1925年,英国塞拉尼斯公司的Henry Drefyus已经开发出第一个甲基羰基化制乙酸的试点装置。然而,由于缺少能耐高压(200atm或更高)和耐腐蚀的容器,此法一度受到抑制[38] 。直到1963年,德国巴斯夫化学公司用钴作催化剂,开发出第一个适合工业生产的办法。到了1968年,以铑为基础的催化剂的(cis−[Rh(CO)2I2]−)被发现,使得反应所需压力减到一个较低的水平并且几乎没有副产物。1970年,美国孟山都公司建造了首个使用此催化剂的设备,此后,铑催化甲基羰基化制乙酸逐渐成为支配性的孟山都法。90年代后期,英国石油成功的将Cativa催化法商业化,此法是基于铱,使用([Ir(CO)2I2]−)[39] ,它比孟山都法更加绿色也有更高的效率,很大程度上排挤了孟山都法。
乙醇氧化法
[编辑]
可用高锰酸钾、重铬酸钾等氧化。
乙醛氧化法
[编辑]在孟山都法商业生产之前,大部分的乙酸是由乙醛氧化制得。尽管不能与甲基羰基化相比,此法仍然是第二种工业制乙酸的方法。乙醛可以通过氧化丁烷或轻石脑油制得,也可以通过乙炔水合后生成。当丁烷或轻石脑油在空气中加热,并有多种金属离子包括镁,钴,铬以及过氧根离子催化,会分解出乙酸。化学方程式如下:
此反应可以在能使丁烷保持液态的最高温度和压力下进行,一般的反应条件是150℃和55 atm。副产物包括丁酮,乙酸乙酯,甲酸和丙酸。因为部分副产物也有经济价值,所以可以调整反应条件使得副产物更多的生成,不过分离乙酸和副产物使得反应的成本增加。
在类似条件下,使用上述催化剂,乙醛能被空气中的氧气氧化生成乙酸
使用新式催化剂,此反应能获得95%以上的乙酸产率。主要的副产物为乙酸乙酯,甲酸和甲醛。因为副产物的沸点都比乙酸低,所以很容易通过蒸馏除去。
乙烯氧化法
[编辑]由乙烯在催化剂(所用催化剂为氯化钯:PdCl2、氯化铜:CuCl2和乙酸锰:(CH3COO)2Mn)存在的条件下,与氧气发生反应生成。此反应可以看作先将乙炔氧化成乙醛,再通过乙醛氧化法制得。
丁烷氧化法
[编辑]丁烷氧化法又称为直接氧化法,这是用丁烷为主要原料,通过空气氧化而制得乙酸的一种方法,也是主要的乙酸合成方法。
2CH3CH2CH2CH3 + 5O2 4CH3COOH + 2H2O
其他方法
[编辑]除上述方法之外,还有许多制取乙酸的方法和途径。
例如:甲烷和一氧化碳或二氧化碳在催化作用下生成乙酸[40]
用途
[编辑]
乙酸是制备很多化合物所需要使用的基本化学试剂。最大的单一使用乙酸的是制备乙酸乙烯酯单体,接下来是制备乙酸酐和其他酯。在醋中的乙酸仅占了所有乙酸中的很小一部分。
乙酸乙烯酯单体
[编辑]乙酸的最主要用途是制备乙酸乙烯酯单体,消耗了大概40%到45%的世界乙酸产量。这个反应是通过乙烯和乙酸在钯催化下与氧气反应。
- 2 CH3COOH + 2 C2H4 + O2 → 2 CH3COOC=CH2 + 2 H2O
乙酸乙烯酯可以聚合形成聚乙酸乙烯酯或其他聚合物,这些聚合物被使用于颜料及粘合剂。
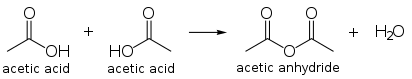
乙酸酐
[编辑]两分子乙酸的缩合产物是乙酸酐,每年全世界生产乙酸酐消耗了大概25%-30%的乙酸。乙酸酐也可以直接通过甲醇羰基化制备。Cativa的设备也可以用来生产乙酸酐。
乙酸酐是一个很强的乙酰化试剂。因此,它的主要用途就是制乙酸纤维素酯,这个合成织物主要用于制作电影胶片。乙酸酐也用来制备阿司匹林和海洛因等其他化合物。
醋
[编辑]以醋的形式,乙酸溶液(一般含5%到18%(质量分数)的乙酸)被用作调味品,也被用来腌蔬菜和其他食物。一般来说,腌菜用的醋在浓度上比一般调味品醋浓度更大。食用醋的总量在世界乙酸年产量中只占一个很小的比例,不过在历史上,这却是一个悠久的应用。
醋的制作方法分为2种:
1. 酿造法
- 最传统的方法,以酒精发酵制成。
2. 化学合成法
- 以冰醋酸稀释后,加入香料调味而成。此方法成本低廉,但风味较差,也容易为不良商人使用。
溶剂
[编辑]冰醋酸是一个良好的极性质子溶剂,常常被用来作为重结晶提纯有机化合物的溶剂。纯的溶融状态的乙酸是生产对苯二甲酸的溶液,对苯二甲酸是制备聚对苯二甲酸乙二酯的重要原料。尽管现在仅有5%-10%的乙酸作此用途,不过据预测,它在今后几十年内将有显著的增长,因为聚对苯二甲酸乙二酯的产量正在增加。
在有碳正离子参与的反应中,常常使用乙酸作为溶液,例如傅-克反应。
冰醋酸在分析化学上被用来与弱碱反应,比如有机氨基化合物。冰醋酸比水的酸性更强而碱性更弱,因此氨基化合物在中间过程中类似于强碱,可以被溶于乙酸中的强酸滴定,比如溶于乙酸的高氯酸;而在水中为强酸的氢卤酸在冰醋酸中只能部分电离,从而体现出其酸性的差别。
其他应用
[编辑]稀释的醋酸溶液因为它温和的酸性也常常被用来作为一种除锈的试剂。它的酸性也被用来治疗被立方水母纲水母刺伤,如果使用及时,可以通过使水母的刺细胞失去效果达到防止严重受伤甚至死亡的效果。也可以用来为使用Vosol治疗外耳炎做准备。同样,乙酸也被用来做成喷射防腐剂,抑制细菌和真菌的生长。
几种用乙酸制备的有机或无机盐:
乙酸的取代产物:
安全性
[编辑]浓度较高的乙酸具有腐蚀性。浓度超过50%的乙酸足以灼伤未破损的皮肤。这种灼伤是慢性的,当皮肤暴露于浓乙酸时,起初不会有任何感觉;如未能及时处理,在0.5到4小时之后暴露部位会起水泡,并产生剧烈持续的疼痛感;此时即使用清水或碳酸氢钠溶液冲洗亦无济于事。浓乙酸亦能对眼、口、鼻等部位的黏膜组织造成不可逆的永久损伤。[6]不同浓度的乙酸溶液的欧盟分级[41]如下表所示:

| 浓度 |
莫耳浓度 | 分级 | R-Phrases |
|---|---|---|---|
| 10%–25% | 1.67–4.16 mol/L | 刺激 (Xi) | R36/38 |
| 25%–90% | 4.16–14.99 mol/L | 腐蚀 (C) | R34 |
| >90% | >14.99 mol/L | 腐蚀 (C) | R10, R35 |
此外,乙酸蒸汽对呼吸道和眼部也具有强烈的刺激性。研究结果显示,在封闭场所中,浓度低至10ppm的乙酸蒸汽就足以对人体造成累积伤害。因此,操作乙酸时需采取适当的防护措施:贮存乙酸的容器须保持密闭;场所需保持良好通风;必要时可穿戴防毒面具、护目镜、防水手套、鞋靴等装备。如吸入过量乙酸蒸汽,则应立即撤离至安全场所;如皮肤、眼睛等部位接触到了乙酸,则应立即以足量清水冲洗暴露部位;如不慎吞服,则可饮用清水稀释之,切勿催吐。以上情况下,伤者均应及时就医。[6][18]
乙酸的闪点为43℃(开杯)/39℃(闭杯),爆炸极限约4%~16%(体积比),自燃点约520℃,介于“可燃”与“易燃”之间。纯乙酸受热可自燃,遇明火可点燃。乙酸的可燃性随含水量的增加而急剧下降,浓度低于56%即不燃。[6][18]
参见
[编辑]- 用途
- 化学
- 相关化合物
参考文献
[编辑]- ^ IUPAC Provisional Recommendations 2004 Chapter P-12.1; page 4 (页面存档备份,存于互联网档案馆)
- ^ Armarego, W.L.F.; Chai, Christina. Purification of Laboratory Chemicals, 6th edition. Butterworth-Heinemann. 2009. ISBN 978-1-85617-567-8.
- ^ Cooper, Caroline. Organic Chemist's Desk Reference 2. CRC Press. 9 August 2010: 102–104. ISBN 978-1-4398-1166-5.
- ^ DeSousa, Luís R. Common Medical Abbreviations. Cengage Learning. 1995: 97. ISBN 978-0-8273-6643-5.
- ^ 歷史月刊 (60–65): 3. 1993.
- ^ 6.00 6.01 6.02 6.03 6.04 6.05 6.06 6.07 6.08 6.09 6.10 6.11 6.12 Frank S. Wagner. John Wiley & Sons, Inc. , 编. Acetic Acid. Hoboken, NJ, USA: John Wiley & Sons, Inc. 2002-07-19 [2021-09-20]. ISBN 9780471238966. doi:10.1002/0471238961.0103052023010714.a01.pub2. (原始内容存档于2022-03-08) (英语).
- ^ Martin, Geoffrey. Industrial and Manufacturing Chemistry Part 1, Organic. London: Crosby Lockwood. 1917: 330–331.
- ^ Adet, P. A. Mémoire sur l'acide acétique (Memoir on acetic acid). Annales de Chimie. 1798, 27: 299–319.
- ^ Thomas Thomson. A System of Chemistry 2. 1817 [2021-09-20]. (原始内容存档于2021-09-26).
- ^ 10.0 10.1 10.2 John Hudson. The History of Chemistry. Boston, MA: Springer US. 1992 [2021-10-10]. ISBN 9781468464436. doi:10.1007/978-1-4684-6441-2 (英语).
- ^ 11.0 11.1 11.2 11.3 Alan J. Rocke. The Quiet Revolution: Hermann Kolbe and the Science of Organic Chemistry. Berkeley: UNIVERSITY OF CALIFORNIA PRESS. 1993 [2021-09-27]. (原始内容存档于2021-09-27).
- ^ 12.0 12.1 Edgar Heilbronner, Foil A. Miller. A Philatelic Ramble Through Chemistry. John Wiley &Sons. 2004: 63 [2021-09-20]. (原始内容存档于2021-09-26).
- ^ Aaron J. Ihde. The Development of Modern Chemistry. Courier Corporation. 1984: 218 [2021-09-20]. (原始内容存档于2021-09-21).
- ^ 14.0 14.1 Edward Frankland. Frankland and Kolbe. London: Macmillan Education UK. 1964: 500–532 [2021-09-20]. ISBN 9781349005567. doi:10.1007/978-1-349-00554-3_16 (英语).
- ^ Benfey, O. Theodor. From vital force to structural formulas. Beckman Center for the History of Chemistry. 1992. ISBN 9780841202733.
- ^ Martin, Geoffrey. Part 1, Organic. Industrial and Manufacturing Chemistry. London: Crosby Lockwood. 1917: 330–31.
- ^ Schweppe, Helmut. Identification of dyes on old textiles. J. Am. Inst. Conservation. 1979, 19 (1/3): 14–23 [2006-10-21]. (原始内容存档于2009-05-29).
- ^ 18.0 18.1 18.2 18.3 Victor H. Agreda (编). Acetic Acid and its Derivatives 0. CRC Press. 1992-12-16 [2021-10-11]. ISBN 9780429179327. doi:10.1201/9781482277272 (英语).
- ^ 19.0 19.1 19.2 19.3 19.4 A Textbook of Organic Chemistry. S CHAND & Company Limited. 2017. ISBN 9789352531967 (英语).
- ^ 20.0 20.1 R. E. Jones, D. H. Templeton. The crystal structure of acetic acid. Acta Crystallographica. 1958-07-10, 11 (7): 484–487 [2021-10-18]. doi:10.1107/S0365110X58001341. (原始内容存档于2021-10-19).
- ^ James B. Togeas. Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments. The Journal of Physical Chemistry A. 2005-06-01, 109 (24): 5438–5444 [2021-10-18]. ISSN 1089-5639. doi:10.1021/jp058004j. (原始内容存档于2021-10-20) (英语).
- ^ Ondřej Socha, Martin Dračínský. Dimerization of Acetic Acid in the Gas Phase—NMR Experiments and Quantum-Chemical Calculations. Molecules. 2020-05-04, 25 (9): 2150 [2021-10-18]. ISSN 1420-3049. PMC 7248931
 . PMID 32375390. doi:10.3390/molecules25092150. (原始内容存档于2022-03-10) (英语).
. PMID 32375390. doi:10.3390/molecules25092150. (原始内容存档于2022-03-10) (英语).
- ^ John Emsley. The solution is the problem. New Scientists. 1986-02-13, 109 (1496): 34. ISSN 0262-4079 (英语).
- ^ G.S. Manku. Theoretical Principles of Inorganic Chemistry. Tata McGraw-Hill. 1980: 333. ISBN 9780070965003 (英语).
- ^ William W. Porterfield (编). Acids, Bases, and Solvents. Elsevier. 1993: 307–358 [2021-10-18]. ISBN 9780125629805. doi:10.1016/b978-0-12-562980-5.50010-5. (原始内容存档于2018-07-02) (英语).
- ^ A. K. Covington, T. Dickinson (编). Physical Chemistry of Organic Solvent Systems. Boston, MA: Springer US. 1973 [2021-10-18]. ISBN 9781468419610. doi:10.1007/978-1-4684-1959-7 (英语).
- ^ John O.Edwards (编). Inorganic Reaction Mechanisms. Wiley. 2007: 345. ISBN 9780470166185 (英语).
- ^ Ian Morris Heilbron (编). Abadole Cytosine. Dictionary Of Organic Compounds 1. Oxford University Press. 1952: 6 (英语).
- ^ Steven S. Zumdahl, Donald J. DeCoste. Introductory Chemistry: A Foundation 9. Cengage Learning. 2018-01-01. ISBN 978-1337399425 (英语).
- ^ 薛超友, 邱凌, 郭俏, 薛泉宏. 沼液中乙酸含量比色测定法研究. 农业资源与环境学报. 2018, 35 (5): 476-482 (中文).
- ^ The International Pharmacopoeia. WHO: 26. 2006 (英语).
- ^ Dictionary of Organic Compounds (6th Edn.), Vol. 1 (1996). London: Chapman & Hall. ISBN 978-0-412-54090-5
- ^ Ferry, J.G. Methane from acetate. Journal of Bacteriology. 1992, 174 (17): 5489–5495 [2011-11-05]. (原始内容存档于2019-06-08).
- ^ Vogels, G.D.; Keltjens J.T., Van Der Drift C. Biochemistry of methane production. Zehnder A.J.B. (编). Biology of anaerobic microorganisms. New York: Wiley. 1988: 707–770.
- ^ Yoneda, Noriyki; Kusano, Satoru; Yasui, Makoto; Pujado, Peter; Wilcher, Steve (2001). Appl. Catal. A: Gen. 221, 253–265.
- ^ "Production report". Chem. Eng. News (July 11, 2005), 67–76.
- ^ Suresh, Bala (2003). "Acetic Acid" (页面存档备份,存于互联网档案馆). CEH Report 602.5000, SRI International.
- ^ Wagner, Frank S. (1978) "Acetic acid." In: Grayson, Martin (Ed.) Kirk-Othmer Encyclopedia of Chemical Technology, 3rd edition, New York: John Wiley & Sons.
- ^ Lancaster, Mike (2002) Green Chemistry, an Introductory Text, Cambridge: Royal Society of Chemistry, pp. 262–266. ISBN 978-0-85404-620-1.
- ^ 王晓红(2002). “CH4 CO2低温转化合成含氧有机物的研究” 17-18 太原理工大学(2002年5月)
- ^ C&L Inventory. echa.europa.eu. [2023-07-18]. (原始内容存档于2021-04-13).
外部链接
[编辑]- 扬子石化
- 化工世界-乙酸页面
- 乙酸(页面存档备份,存于互联网档案馆)
- (英文)CID 176 PubChem的链接
- (英文)计算化学维基
- (英文)物质安全数据
- (英文)美国国家污染物质列表-乙酸现状
- (英文)国立职业安全与健康研究所化学品危害手册(页面存档备份,存于互联网档案馆)
- (英文)29 CFR 1910.1000, Table Z-1(页面存档备份,存于互联网档案馆)(美国允许暴露极限值)
- (英文)美国国家防火协会职业训练表
- (英文)塞拉尼斯官方网站(页面存档备份,存于互联网档案馆)
- (英文)乙酸的用法 有机合成
- (英文)乙酸的pH和滴定 - 数据分析,模拟及生成图表的免费软件(页面存档备份,存于互联网档案馆)
- (英文)ChemSub Online: CAS号 64-19-7, 乙酸(页面存档备份,存于互联网档案馆)
























![{\displaystyle {\ce {{CH4}+{CO}+{1/2}O2->[{Pd/Cu}][{CF_{2}COOH}]CH3COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6172a16b55ae1829cf54716ba3d58a36d230046)
![{\displaystyle {\ce {{CH4}+CO2->[{Pd/Cu,K_{2}S_{2}O_{3}}][{CF_{2}COOH}]CH3COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/93a9ae1a1b58fc7bb5d910d2abfc24f62dc2a277)
![{\displaystyle {\ce {{CH4}+CO->[{HF-SbF_{5}orFSO_{3}H-SbP_{5},H_{2}O}][{CF_{3}COOH}]CH3COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9bea4fc1168053c8bb15df96c6f4e67d44ae2551)