盐 (化学)
此条目需要补充更多来源。 (2021年8月9日) |

盐在化学中,是指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物,如硫酸钙,氯化铜,醋酸钠,一般来说盐是复分解反应的生成物,如硫酸与氢氧化钠生成硫酸钠和水,也有其他的反应可生成盐,例如置换反应。
盐分为单盐和合盐,单盐分为正盐、酸式盐、碱式盐,合盐分为复盐和错盐。其中酸式盐除含有金属离子与酸根离子外还含有氢离子,碱式盐除含有金属离子与酸根离子外还含有氢氧根离子,复盐溶于水时,可生成与原盐相同离子的合盐;错盐溶于水时,可生成与原盐不相同的复杂离子的合盐——配合物。
通常在标准状况下,不可溶的盐会是固态,但也有例外,例如熔盐及离子液体。可溶盐的溶液及熔盐有导电性,因此可作为电解质。包括细胞的细胞质、血液、尿液及矿泉水中都含有许多不同的盐类。
强碱弱酸盐是强碱和弱酸反应的盐,溶于水显碱性,如碳酸钠。而强酸弱碱盐是强酸和弱碱反应的盐,溶于水显酸性,如氯化铁。
盐的性质
[编辑]在化学上,盐是由阳离子(正电荷离子)与阴离子(负电荷离子)所组成之电中性(不带电荷)离子化合物。
- 碱(可溶)+盐(可溶)→新碱+新盐
- 和盐发生反应。复分解反应。
- 盐(可溶)+盐(可溶)→两种新盐
- 和某些金属反应。置换反应
- 盐+金属(某些)→新金属+新盐 反应中的金属一定要比盐中的金属活泼才可以把它给置换出来。请看金属活动性。
盐的分类
[编辑]单盐
[编辑]- 正盐:
正盐是盐类的一种,既不含能电离的氢离子,又不含氢氧根离子。 正盐是酸和碱完全中和的产物[1],但正盐的水溶液不一定显中性,如(碳酸钠)溶液显碱性,(硫酸铵)溶液显酸性。酸跟碱完全中和生成的盐中,不会有酸中的氢离子,也不会有碱中的氢氧根离子,只有金属阳离子和酸根离子,这样的盐为正盐。
- 酸式盐:

酸式盐是盐类的一种,由阳离子和多元酸的不完全电离酸根阴离子组成。由于阴离子中含有在水中可电离的氢原子,因此被称作“酸式”盐[1]。但实际上,只有强酸(如硫酸)及少部分中强酸(如磷酸)的酸式盐呈酸性,大多数弱酸的酸式盐都因阴离子的水解而显碱性。
要注意的是,酸式盐在以离子晶体形式存在时,阴离子并不电离出氢离子,氢离子是酸式酸根离子的一部分。在熔融状态下,酸根离子也不电离。
- 碱式盐:
碱式盐是盐类的一种,除了含有金属离子和酸根离子外,还含有氢氧根或氧离子的盐类;也可认为是碱的氢氧根没有被酸完全中和所得的产物。 含羟基的碱式盐又称为羟基盐,可视为金属离子、氢氧根及阴离子合成的盐类,如碱式碳酸铜()、碱式氯化镁()等为羟基盐。
含氧基的碱式盐称为氧化盐,可视为金属离子、氧离子(O2-)及阴离子合成的盐类。如碱式碳酸铋()即为氧化盐。
合盐
[编辑]- 复盐:
复盐是指含有两种或以上的同种晶型的简单盐类[1],属于化合物,溶于水会离解出所有的离子。复盐通常可由混合这两种盐饱和溶液并结晶而制得。在自然界中广泛存在,如明矾就是天然而有广泛应用的复盐。
络盐
[编辑]- 错盐:
错盐有配位单元的化合物。
盐的属性
[编辑]颜色
[编辑]盐的颜色可以是纯净透明的(如氯化钠)、不透明的或者是带有金属光泽的(如黄铁矿)。大多数情况下盐表面的透明或不透明只和构成该盐的单晶体有关。当光线照射到盐上时,就会被晶界(晶体之间的边界)反射回来,大的晶体就会呈现出透明状,多晶体聚集在一起则会看起来更像白色粉末一样。
盐有许多颜色,例如(溶液):
大部分矿物质、无机色素以及很多人工合成的有机染料都是盐,有一些盐能够呈现出其它颜色是过渡元素的d轨道存在未成对电子导致的。
味道
[编辑]不同的盐可以激发不同的味觉,例如咸味(氯化钠)、甜味(乙酸铅[2],若大量食用会导致铅中毒)、酸味(酒石酸氢钾)、苦味(硫酸镁)或鲜味(谷氨酸钠)[3]。
气味
[编辑]强酸或强碱盐(强盐)是不可挥发的,且没有气味。而弱酸或弱碱盐(弱盐)则会根据共轭酸碱对而产生不同的气味(例如醋酸盐则会有醋酸的味道,氰化氢则会有苦杏仁味等),此外弱酸或弱碱盐还会挥发和分解,并且由于水解反应和弱盐合成的反应是可逆反应,因此当有水分存在时会加速弱盐的分解。
溶解度
[编辑]许多离子化合物都可以溶解在水或是类似的溶剂中,化合物的溶解度和组成的阴离子和阳离子以及溶剂都有关,因此有一特定的关系。阳离子当中,所有钠离子、钾离子及铵离子的盐均可溶于水;而阴离子中,硝酸盐离子及碳酸氢盐离子的盐类可在水中溶解。除了硫酸钡、硫酸钙及硫酸铅外,大部分的硫酸盐离子的盐类也都可以溶于水。而卤素盐(氯、溴、碘),则汞、铜、银、铊、铅不溶。不过若离子之间的键结很强,产生高度稳定的固体,在水中也就不易溶解,例如大部分的碳酸盐就不溶于水,例如碳酸铅及碳酸钡等。 盐的溶解性口诀:
钾钠铵盐都易溶,
硝酸盐遇水无影踪,
硫酸盐不溶铅和钡,
盐酸盐不溶银亚汞,
碳酸盐除钾钠铵外都不溶。
系统命名法
[编辑]一般而言,无氧酸盐的名字是非金属元素名称在前,金属元素名称在后,两者名字之间添加“化”,称为“某化某”。如果是含氧酸盐,则盐的名称为酸的名称后面之间添加元素名称,称为“某酸某”。如果某种金属元素有多个化合价,那么低化合价形成的盐的名称是在金属元素名称前添加“亚”,例如铜元素的氯化物中,如果铜的化合价为+2价,那么形成的盐CuCl2称为“氯化铜”,如果化合价为+1价,形成的盐CuCl称为“氯化亚铜”。
含有相同阳离子或阴离子的一类盐一般都会统称为“某盐”,例如“钠盐”、“硫酸盐”等。
常见的形成盐类的阳离子包括:
常见的形成盐类的阴离子包括:
- 乙酸根CH3COO−(乙酸)
- 碳酸根CO32−(碳酸)
- 氯离子Cl−(盐酸)
- 氰化物C≡N−(氰化氢)
- 硝酸根NO3−(硝酸)
- 亚硝酸根NO2−(亚硝酸)
- 磷酸根PO43−(磷酸)
- 硫酸根SO42−(硫酸)
- 硼酸根BO33- (硼酸)
有机离子的盐类
[编辑]一般盐类会归类为无机化合物,但也有一些有机化合物的盐类,例如有机酸的盐类就是有机化合物。其中较重要的是羧酸盐,例如乙酸根CH3COO−和钠离子Na+会形成乙酸钠,和铜离子Cu2+会形成乙酸铜。乙酸只有一个COOH基,只带-1价,柠檬酸有三个COOH基,带-3价,形成的盐类有柠檬酸钠和柠檬酸钙根,乙酸盐和柠檬酸盐的阴离子和阳离子都以离子键键结,不像一般有机化合物以间用共价键键结,因此称为盐类。
这些盐类中较常用的是羧酸盐,其中也包括脂肪酸盐。像肥皂就是由许多不同分子量脂肪酸钠及脂肪酸钾的混合物。这类长链脂肪酸的盐类就没有晶体的结构。
类似硫酸根SO42−的磺酸根也是有机酸根的一种,磺酸盐是洗发精及沐浴乳中常见的表面活性剂。醇类的酸性很弱,一般不会称为酸,不过其羟基氢被金属取代后会形成醇盐。醇盐在水中会水解,产生对应的醇类,以下是醇盐和金属碱酐水解反应的比较。
| 水解反应 | |
|---|---|
| 乙醇钠 | |
| 氧化钠 | |

也有些有机的阳离子会形成盐类,例如类似铵根离子(NH4+)的季铵阳离子,季铵阳离子是由一个氮原子和四个烷基()组成,带一个正电荷。例如溴化十六烷基三甲铵中,十六烷基三甲铵离子是阳离子,和阴离子溴离子形成盐类。实用的季铵盐类也有类似的结构,季铵阳离子中只有一个长链的烷基,当溶于水中,阳离子有表面活性剂的作用。这类物质在生物体新陈代谢中有重要的作用,例如维生素B中的胆碱就是季铵盐类。
在氨分子(NH3)中加入一个氢离子(H+)就变成铵离子(NH4+),同样的在有机胺中加入一个氢离子就变成阳离子。例如一级胺(,R为烷基)加入一个氢离子就变成阳离子()这类的化合物比原来的化合物极性要强,因此在水中的溶解度比原来的化合物要高。例如一些含氮的药物会和盐酸反应来产生盐酸胺类化合物,人体对于这类化合物的吸收度比原来的含氮药物要好。也有些药物是和溴化氢或氟化氢反应成类似的药物。
内盐也称为两性离子,是一种特殊的化合物,化合物中同时有带正电及带负电的原子,但是带正电和负电的原子不同(在一些定义中限定是未具有相邻正负电荷的化合物)[4],像许多氨基酸都属于内盐。若氨基酸中包含羧基()和一个胺基(),就是内盐,会在不同的反应中呈酸性或是碱性。不过内盐和一般电解质不同,溶于水中只有微弱的导电性(两性物质)。
有机阴离子和阳离子的例子
[编辑]| 有机化合物的阴离子 | ||
|---|---|---|
| 分类 | 举例 | 结构 |
| 羧酸根 | 乙酸根 |  |
| 棕榈酸根 |  | |
| 柠檬酸 |  | |
| 有机硫化物 | 十二烷基硫酸根 |  |
| 醇盐 | 乙醇盐 | |
| 有机化合物的阳离子 | ||
| 分类 | 举例 | 结构 |
| 季铵阳离子 | 溴化十六烷基三甲铵 |  |
| 胆碱 |  | |
| 胺类 | 苯胺盐类 |  |
| 有机化合物的内盐 | ||
| 分类 | 举例 | 结构 |
| 甜菜碱 | 甜菜碱 |  |
| 氨基酸 | 丙胺酸 | 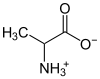 |
盐的制备
[编辑]盐可以通过化学反应而制备,包括有:
- 盐基与酸,例如NH3 + HCl → NH4Cl
- 金属与酸,例如Mg + H2SO4 → MgSO4 + H2
- 金属与非金属,例如Ca + Cl2 → CaCl2
- 碱与酸性氧化物,例如2 NaOH + Cl2O → 2 NaClO + H2O
- 酸与碱性氧化物,例如2 HNO3 + Na2O → 2 NaNO3 + H2O
- 盐也可以由不同的盐溶液混合,其中的离子发生重组,形成溶解度较低的盐(另见:溶解平衡),例如
参见
[编辑]参考资料
[编辑]- ^ 1.0 1.1 1.2 魏明通. 普通化學. 五南图书出版股份有限公司. 2006: 24– [2014-06-12]. ISBN 978-957-11-4349-1. (原始内容存档于2014-07-28).
- ^ Nicholas Wade. 地球身世之謎. 知书房出版集团. 2004: p.159 [2014-06-12]. ISBN 9578320477. (原始内容存档于2014-07-14).
- ^ Y. Kawamura and M.R. Kare (编). 鮮味,基本味道. New York,NJ: Marcel Dekker. 1987.
- ^ International Union of Pure and Applied Chemistry (IUPAC), The IUPAC Compendium of Chemical Terminology,4-th ed. (The Gold Book) (1997)。在线校正版: (2006–) "zwitterionic compounds/zwitterions"。doi:10.1351/goldbook.Z06752



















