穀氨酸
| 穀氨酸 | |
|---|---|
| |

| |
| |

| |
| IUPAC名 Glutamic acid 2-Aminopentanedioic acid 2-氨基戊二酸 | |
| 縮寫 | Glu, E |
| 識別 | |
| CAS號 | 56-86-0((L isomer)) 617-65-2((D/L racemate)) |
| ChemSpider | 591 |
| SMILES |
|
| InChI |
|
| InChIKey | WHUUTDBJXJRKMK-UHFFFAOYAD |
| ChEBI | 18237 |
| KEGG | D0434 |
| 性質 | |
| 化學式 | C5H9NO4 |
| 摩爾質量 | 147.13 g·mol⁻¹ |
| 熔點 | 247~249 ℃ |
| 溶解性(水) | 8.57 g/L [1] |
| 溶解性 | 乙醇: 350 μg/100 g (25 °C)[2] |
| pKa | 2.10, 4.07, 9.47[3] |
| 磁化率 | −78.5·10−6 cm3/mol |
| 危險性 | |
GHS危險性符號
| |
| GHS提示詞 | Warning |
| H-術語 | H315, H319, H335 |
| P-術語 | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362, P403+233, P405 |
| NFPA 704 | |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
| 「Glutamic acid」的各地常用名稱 | |
|---|---|
| 中國大陸 | 穀氨酸 |
| 臺灣 | 麩胺酸 |
| 港澳 | 穀氨酸 |
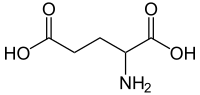
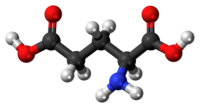
穀氨酸(英語:Glutamic acid,符號 Glu或E[4],陰離子英文寫作 glutamate),學名α-氨基戊二酸,是一種 α-氨基酸,幾乎所有生物都在蛋白質的生物合成中使用它。穀氨酸是組成生物體內各種蛋白質的20種氨基酸之一。它是人類的非必需氨基酸,這意味着人體可以合成足夠的營養素來供其使用。 它也是脊椎動物神經系統中最豐富的興奮性神經遞質。 它是 GABA 能神經元中合成抑制性γ-氨基丁酸 (GABA) 的前體。
其分子式為C
5H
9NO
4。穀氨酸以兩種旋光異構體形式存在; 右旋L型通常是透過麩質水解或從甜菜糖生產廢水或發酵中獲得的[5]。其分子結構可理想化為HOOC−CH(NH
2)−(CH
2)2−COOH,具有兩個羧基-COOH和一個氨基−NH
2。
歷史
[編輯]儘管穀氨酸和其他氨基酸天然存在於許多食物中,但直到20世紀初才透過科學手段鑑定出其風味貢獻。 這種物質是由德國化學家卡爾·里特豪森(Karl Heinrich Ritthausen)於1866年發現並鑑定的,他用硫酸處理了小麥麩質(因此得名麩質gluten)[6]。 1908年,日本東京帝國大學研究員池田菊苗鑑定出大量海帶湯蒸發後留下的棕色結晶是穀氨酸。 這些晶體在品嚐時,重現了他在許多食物中發現的不可言喻但不可否認的味道,尤其是在海藻中。 池田教授將這種味道稱為鮮味(日語:旨味、umami)。 隨後,他獲得了大規模生產穀氨酸結晶鹽、味精(穀氨酸鈉, Monosodium glutamate, MSG)的方法的專利[7][8]。
化學
[編輯]電離
[編輯]
當穀氨酸溶於水時,氨基(−NH
2)可能獲得質子(H+
),和/或羧基可能會失去質子,這取決於介質的酸度。
在足夠酸性的環境中,兩個羧基都被質子化,分子變成帶有單一正電荷的陽離子,HOOC−CH(NH+
3)−(CH
2)2−COOH.[9]
在pH值約2.5至4.1之間時,[9] 更接近胺的羧酸通常會失去一個質子,酸變成中性的兩性離子,−OOC−CH(NH+
3)−(CH
2)2−COOH。這也是結晶固態化合物的形式。[10][11]質子化狀態的改變是逐漸進行的;在pH值為2.10時,兩種形式的濃度相等。[12]
在較高的pH值下,另一個羧酸基失去其質子,酸幾乎完全以穀氨酸陰離子的形式存在−OOC−CH(NH+
3)−(CH
2)2−COO−,整體帶有單一負電荷。質子化狀態的改變發生在pH值為4.07時。[12]這種兩種缺乏質子的羧酸鹽的形式在生理pH值範圍 (7.35–7.45) 中佔主導地位。
在更高的pH值下,氨基會失去額外的質子,而普遍存在的物質是雙負離子−OOC−CH(NH
2)−(CH
2)2−COO−。質子化狀態的變化發生在pH值為9.47時。[12]
光學異構現象
[編輯]穀氨酸是手性的; 存在兩種鏡像對映異構體:d(−) 和 l(+)。 l型在自然界中更廣泛存在,但d型出現在一些特殊的環境中,例如細菌的莢膜和細菌的細胞壁(通過穀氨酸消旋酶從l型產生它)和哺乳動物的肝臟.[13][14]
合成
[編輯]生物合成
[編輯]| 反應物 | 產物 | 酶 | |
|---|---|---|---|
| 穀氨醯胺 + H2O | → | Glu + NH3 | GLS, GLS2 |
| NAcGlu + H2O | → | Glu + 乙酸鹽 | N-Acetyl-glutamate synthase |
| α-Ketoglutarate + 煙酰胺腺嘌呤二核苷酸磷酸H + NH4+ | → | Glu + 煙酰胺腺嘌呤二核苷酸磷酸+ + H2O | GLUD1, GLUD2[15] |
| α-Ketoglutarate + α-amino acid | → | Glu + α-keto acid | Transaminase |
| 1-Pyrroline-5-carboxylate + NAD+ + H2O | → | Glu + NADH | ALDH4A1 |
| N-Formimino-L-glutamate + FH4 | → | Glu + 5-formimino-FH4 | FTCD |
| NAAG | → | Glu + NAA | GCPII |
工業合成
[編輯]穀氨酸是氨基酸中生產規模最大的,2006年估計年產量約150萬噸。[16]
穀氨酸的生物重要性
[編輯]- 穀氨酸是動物體內中樞神經系統的一種重要的興奮性神經遞質。它的特異性受體有三大類:AMPA(α-氨基-3-羥基-5-甲基-4-異唑丙酸),NMDA(N-甲基-D-天冬氨酸)和卡英酸(Kainate,紅藻氨酸/海人藻酸)。
- 穀氨酸,在醫學上主要用於治療肝性昏迷,還用於改善兒童智力發育;食品工業上,味精是常用的增鮮劑,其主要成分是穀氨酸鈉鹽。
- 加工食品常含有人工抽取的穀氨酸,在食物包裝上以不同名稱列出。有研究[來源請求]指出會影響新陳代謝,增加肥胖的機會,甚至影響其他身體機能。
功能與用途
[編輯]代謝
[編輯]穀氨酸是細胞代謝中的關鍵化合物。 在人類中,膳食蛋白質經由消化分解成氨基酸,氨基酸作為體內其他功能作用的代謝燃料。 氨基酸降解的關鍵過程是轉氨基作用,其中氨基酸的氨基轉移為 α-酮酸,通常由轉氨酶催化。這種反應可以概括為:
- R1-氨基酸 + R2-α-酮酸 ⇌ R1-α-酮酸 + R2-氨基酸
一種非常常見的α-酮酸是α-酮戊二酸,它是檸檬酸循環的中間體。α-酮戊二酸的轉氨作用產生穀氨酸。所得的 α-酮酸產品通常也是有用的,它可以作為燃料或作為進一步代謝過程的基質。
丙酮酸和草酰乙酸都是細胞代謝的關鍵成分,在糖酵解作用、糖質新生作用和檸檬酸循環等基本過程中充當基質或中間體。
神經遞質
[編輯]穀氨酸是脊椎動物神經系統中最豐富的興奮性神經遞質(英語:neurotransmitter)。[17] 在化學突觸中,穀氨酸儲存在囊泡中。神經衝動觸發突觸前細胞釋放穀氨酸。穀氨酸作用於離子型和代謝型(G蛋白偶聯)受體。[17] 在相對的突觸後細胞中,穀氨酸受體(例如NMDA受體或AMPA受體)與穀氨酸結合並被活化。由於其在突觸可塑性中的作用,穀氨酸參與大腦中的學習和記憶等認知功能。[18]被稱為長期增強作用 (LTP) 的可塑性形式發生在海馬體、新皮質和大腦其他部分的穀氨酸突觸中。穀氨酸不僅充當點對點發射器 (point-to-point transmitter),還透過突觸之間的溢出突觸串擾起作用,其中從鄰近突觸釋放的穀氨酸的總和創建突觸外信號/大批量傳輸。[19]此外,正如馬克·馬特森 (Mark Mattson) 最初描述的那樣,穀氨酸在大腦發育過程中生長錐和突觸發生 (synaptogenesis) 的調節中發揮重要作用。
大腦非突觸穀氨酸訊號傳導迴路
[編輯]發現果蠅大腦中的細胞外穀氨酸透過涉及受體脫敏的過程來調節突觸後穀氨酸受體聚集。[20]神經膠質細胞中表現的基因主動將穀氨酸轉運到細胞外空間,[20],而在刺激伏隔核II類代謝型穀氨酸受體中,該基因被發現可以降低細胞外穀氨酸水平。[21]這提出了這種細胞外穀氨酸作為更大的穩態系統的一部分發揮「類似內分泌」作用的可能性。
GABA前體
[編輯]此章節尚無任何內容,需要擴充。 |
增味劑
[編輯]穀氨酸是蛋白質的組成部分,存在於含有蛋白質的食物中,但只有以未結合的形式存在時才能品嚐。多種食物中都含有大量的遊離穀氨酸,包括乾酪和醬油,穀氨酸負責鮮味,鮮味是人類味覺的五種基本味道之一。穀氨酸通常以其鈉鹽(稱為味精(MSG))的形式用作食品添加劑和風味增強劑。
營養
[編輯]此章節尚無任何內容,需要擴充。 |
植物生長劑
[編輯]Auxigro是一種含有30%穀氨酸的植物生長製劑。
核磁共振波譜
[編輯]近年來,[何時?]人們對殘餘偶極耦合 (Residual dipolar coupling, RDC) 在核磁共振波譜 (NMR) 中的應用進行了大量研究。穀氨酸衍生物聚-γ-芐基-L-穀氨酸 (PBLG) 通常用作對齊介質來控制觀察到的偶極相互作用的規模。[22]
穀氨酸在衰老中的作用
[編輯]此章節尚無任何內容,需要擴充。 |
藥理學
[編輯]此章節尚無任何內容,需要擴充。 |
參見
[編輯]參考文獻
[編輯]- ^ L-Glutamic acid. National Library of Medicine. [24 June 2023]. (原始內容存檔於2023-10-06).
- ^ Belitz, H.-D.; Grosch, Werner; Schieberle, Peter. Food Chemistry. Springer. 2009-02-27. ISBN 978-3540699330.
- ^ Amino Acid Structures. cem.msu.edu. (原始內容存檔於1998-02-11).
- ^ Nomenclature and Symbolism for Amino Acids and Peptides. IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983 [2018-03-05]. (原始內容存檔於2017-08-29).
- ^ Webster's Third New International Dictionary of the English Language Unabridged, Third Edition, 1971.
- ^ R. H. A. Plimmer. R. H. A. Plimmer; F. G. Hopkins , 編. The Chemical Constitution of the Protein. Monographs on biochemistry. Part I. Analysis 2nd. London: Longmans, Green and Co. 1912: 114 [1908] [June 3, 2012].
- ^ Renton, Alex. If MSG is so bad for you, why doesn't everyone in Asia have a headache?. The Guardian. 2005-07-10 [2008-11-21]. (原始內容存檔於2008-10-12).
- ^ Kikunae Ikeda Sodium Glutamate. Japan Patent Office. 2002-10-07 [2008-11-21]. (原始內容存檔於2007-10-28).
- ^ 9.0 9.1 Albert Neuberger (1936), "Dissociation constants and structures of glutamic acid and its esters". Biochemical Journal, volume 30, issue 11, article CCXCIII, pp. 2085–2094. PMC 1263308
 .
.
- ^ Rodante, F.; Marrosu, G. Thermodynamics of the second proton dissociation processes of nine α-amino-acids and the third ionization processes of glutamic acid, aspartic acid and tyrosine. Thermochimica Acta. 1989, 141: 297–303. Bibcode:1989TcAc..141..297R. doi:10.1016/0040-6031(89)87065-0.
- ^ Lehmann, Mogens S.; Koetzle, Thomas F.; Hamilton, Walter C. Precision neutron diffraction structure determination of protein and nucleic acid components. VIII: the crystal and molecular structure of the β-form of the amino acidl-glutamic acid. Journal of Crystal and Molecular Structure. 1972, 2 (5): 225–233. Bibcode:1972JCCry...2..225L. S2CID 93590487. doi:10.1007/BF01246639.
- ^ 12.0 12.1 12.2 William H. Brown and Lawrence S. Brown (2008), Organic Chemistry (5th edition). Cengage Learning. p. 1041. ISBN 0495388572、978-0495388579.
- ^ National Center for Biotechnology Information, "D-glutamate (頁面存檔備份,存於互聯網檔案館)". PubChem Compound Database, CID=23327. Accessed 2017-02-17.
- ^ Liu, L.; Yoshimura, T.; Endo, K.; Kishimoto, K.; Fuchikami, Y.; Manning, J. M.; Esaki, N.; Soda, K. Compensation for {{{2}}}-glutamate auxotrophy of Escherichia coli WM335 by {{{2}}}-amino acid aminotransferase gene and regulation of murI expression. Bioscience, Biotechnology, and Biochemistry. 1998, 62 (1): 193–195. PMID 9501533. doi:10.1271/bbb.62.193
 .
.
- ^ Grabowska, A.; Nowicki, M.; Kwinta, J. Glutamate dehydrogenase of the germinating triticale seeds: Gene expression, activity distribution and kinetic characteristics. Acta Physiologiae Plantarum. 2011, 33 (5): 1981–1990. doi:10.1007/s11738-011-0801-1
 .
.
- ^ Alvise Perosa; Fulvio Zecchini. Methods and Reagents for Green Chemistry: An Introduction. John Wiley & Sons. 2007: 25. ISBN 978-0-470-12407-9.
- ^ 17.0 17.1 Meldrum, B. S. Glutamate as a neurotransmitter in the brain: Review of physiology and pathology. The Journal of Nutrition. 2000, 130 (4S Suppl): 1007S–1015S. PMID 10736372. doi:10.1093/jn/130.4.1007s
 .
.
- ^ McEntee, W. J.; Crook, T. H. Glutamate: Its role in learning, memory, and the aging brain. Psychopharmacology. 1993, 111 (4): 391–401. PMID 7870979. S2CID 37400348. doi:10.1007/BF02253527.
- ^ Okubo, Y.; Sekiya, H.; Namiki, S.; Sakamoto, H.; Iinuma, S.; Yamasaki, M.; Watanabe, M.; Hirose, K.; Iino, M. Imaging extrasynaptic glutamate dynamics in the brain. Proceedings of the National Academy of Sciences. 2010, 107 (14): 6526–6531. Bibcode:2010PNAS..107.6526O. PMC 2851965
 . PMID 20308566. doi:10.1073/pnas.0913154107
. PMID 20308566. doi:10.1073/pnas.0913154107  .
.
- ^ 20.0 20.1 Augustin H, Grosjean Y, Chen K, Sheng Q, Featherstone DE. Nonvesicular Release of Glutamate by Glial xCT Transporters Suppresses Glutamate Receptor Clustering In Vivo. Journal of Neuroscience. 2007, 27 (1): 111–123. PMC 2193629
 . PMID 17202478. doi:10.1523/JNEUROSCI.4770-06.2007.
. PMID 17202478. doi:10.1523/JNEUROSCI.4770-06.2007.
- ^ Zheng Xi; Baker DA; Shen H; Carson DS; Kalivas PW. Group II metabotropic glutamate receptors modulate extracellular glutamate in the nucleus accumbens. Journal of Pharmacology and Experimental Therapeutics. 2002, 300 (1): 162–171. PMID 11752112. doi:10.1124/jpet.300.1.162.
- ^ C. M. Thiele, Concepts Magn. Reson. A, 2007, 30A, 65–80
外部鏈接
[編輯]- (英文)穀氨酸的質譜(Mass spectrom) (頁面存檔備份,存於互聯網檔案館)


