一氧化二氮
此條目需要補充更多來源。 (2014年1月24日) |
| 一氧化二氮 | |
|---|---|

| |
| |
| |
| IUPAC名 Nitrous oxide 氧化亞氮 | |
| 別名 | 笑氣 |
| 識別 | |
| CAS號 | 10024-97-2 |
| PubChem | 948 |
| ChemSpider | 923 |
| SMILES |
|
| InChI |
|
| Beilstein | 8137358 |
| Gmelin | 2153410 |
| UN編號 | 1070(壓縮氣體) 2201(液體) |
| ChEBI | 17045 |
| RTECS | QX1350000 |
| DrugBank | DB06690 |
| KEGG | D00102 |
| 性質 | |
| 化學式 | N2O |
| 摩爾質量 | 44.0128 g·mol⁻¹ |
| 外觀 | 無色氣體 |
| 密度 | 1.2228 g/cm3(液態) 1.8 g/L(氣態,標準狀態) |
| 熔點 | -90.86 °C (182.29 K) |
| 沸點 | -88.48 °C (184.67 K) |
| 溶解性(水) | 0.15 g/100 ml (15 °C) |
| 溶解性 | 易溶於乙醇,醚,硫酸 |
| log P | 0.35 |
| 蒸氣壓 | 5150 kPa (20 °C) |
| 結構 | |
| 分子構型 | 直線型 |
| 偶極矩 | 0.166D |
| 熱力學 | |
| ΔfHm⦵298K | +82.05 |
| 藥理學 | |
| 妊娠分類 | C(美) |
| 藥代動力學: | |
| 5 分鐘 | |
| 危險性 | |
| 警示術語 | R:R8 |
| 安全術語 | S:S38 |
| 歐盟編號 | 氧化劑 [O] |
| NFPA 704 | |
| 閃點 | 非易燃 |
| 相關物質 | |
| 相關化學品 | 一氧化氮、二氧化氮、三氧化二氮、四氧化二氮、五氧化二氮、硝酸、亞硝酸 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
一氧化二氮,又稱氧化亞氮(英語:Nitrous oxide),俗稱笑氣,化學式為N2O,是一種無色有甜味氣體,在一定條件下能支持燃燒,但在室溫下穩定,有輕微麻醉作用,其麻醉作用於1799年由英國化學家漢弗萊·戴維發現[1]。該氣體早期被用於牙科手術的麻醉,現用在外科手術和牙科。「笑氣」的名稱是由於吸入它會感到欣快,並能致人發笑。一氧化二氮能溶於水、乙醇、乙醚及濃硫酸,但不與水反應。它可以用來作為火箭和賽車的氧化劑,以及增加發動機的輸出功率。在食品行業中,氧化亞氮可作為添加劑,用於打發奶泡與製作咖啡。一氧化二氮是強溫室氣體。現笑氣被用在很多娛樂場所[2]。
歷史
[編輯]一氧化二氮最早是在1772年由英國化學家約瑟夫·普利斯特里合成,他將之稱為「燃素的亞硝酸氣」[3]。普利斯特里將這一發現寫進了他的書《不同類型氣體的實驗與觀察》(1775年),在書中他描述了通過加熱鐵屑和硝酸的混合物來製備這種氣體[4]。
18世紀90年代,漢弗萊·戴維和他的朋友,包括詩人柯爾律治和羅伯特·騷塞試驗了這種氣體。他們發現一氧化二氮能使病人喪失痛覺,而且吸入後仍然可以保持意識,不會神智不清(現代研究表明吸入過量一氧化二氮後會使人神智不清)。
1844年12月11日,一氧化二氮首次被當作麻醉劑在醫學治療中使用,牙醫霍勒斯·威爾士在拔牙過程中使用一氧化二氮減輕病人疼痛[5]。
製備
[編輯]工業生產
[編輯]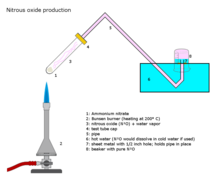
工業上在約250°C的溫度下小心加熱硝酸銨可以生成一氧化二氮和水蒸汽。[6][7]
添加各種磷酸鹽有利於在稍低的溫度下形成更純的氣體。該反應可能難以控制,從而導致爆炸。[8]
實驗室製備
[編輯]硝酸銨的分解也是製備氣體的常用實驗室方法。同樣也可以通過加熱硝酸鈉和硫酸銨的混合物製得:[9]
另一種方法涉及尿素、硝酸和硫酸的反應:[10]
據報道,可用二氧化錳-三氧化二鉍催化劑直接氧化氨:[11]參考奧斯特瓦爾德法。
鹽酸羥胺與亞硝酸鈉反應生成一氧化二氮。如果將亞硝酸鹽添加到羥胺溶液中,則唯一剩餘的副產物是鹽水。但是,如果將羥胺溶液添加到亞硝酸鹽溶液中(亞硝酸鹽過量),則會形成有毒的高級氮氧化物:
連二次硝酸會分解為一氧化二氮和水,在25°C,pH值1–3時的半衰期為16天。 [12]
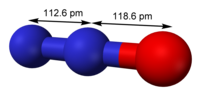
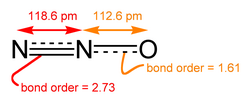
結構與性質
[編輯]一氧化二氮的分子是直線型結構。其中一個氮原子與另一個氮原子相連,而第二個氮原子又與氧原子相連。它可以被認為是
- 和
的共振雜化體。
一氧化二氮可以被氧化為更高價的氮氧化物,如一氧化氮NO和二氧化氮NO2。
將一氧化二氮與沸騰汽化的鹼金屬反應可以生成一系列的亞硝酸鹽,在高溫下,一氧化二氮也可以氧化有機物。
應用
[編輯]一氧化二氮是一種助燃劑,最初用在幫助二戰時德軍飛機迅速逃離戰場,現今用於改裝汽車上,用於直線加速。
增加車輛速度
[編輯]使用氮氧加速系統的改裝車輛將一氧化二氮送入引擎,遇熱分解成氮氣和氧氣,提高引擎燃燒率,增加速度。氧氣有助燃作用,加快燃料燃燒。
火箭氧化劑
[編輯]一氧化二氮可以用作火箭氧化劑。比其他氧化劑更好的地方是因為它是無毒的,在室溫下穩定,易於儲存和相對安全地進行飛行。第二個好處是可以很容易分解成幫助呼吸的空氣。
用作麻醉劑
[編輯]醫生會讓病人吸入一氧化二氮和氧氣,以降低對疼痛的感覺,同時讓病人在清醒狀態。
食品加工
[編輯]因不易與奶油中的成分發生反應,多用做奶油發泡劑。
安全性
[編輯]人可能因為在吸入笑氣時氧氣過少而引起突然的窒息。暴露於笑氣中會短時間導致智力,視聽能力,手的靈活度降低。長期接觸可引起維生素B群缺乏症,肌肉麻痺等。
一氧化二氮的主要安全隱患在於,它是一種有分解性的麻醉劑,而且通常以加壓液化的形式儲存。在正常儲存時,它是很穩定的,使用起來也很安全。但是如果錯誤地使用,它會很容易分解而且很有可能爆炸。液態的一氧化二氮是有機物的良好溶劑,不過用它製成溶液有可能會生成一些對外界刺激敏感的爆炸性物質。一部分火箭事故由於一氧化二氮被燃料污染而發生,少量的一氧化二氮和燃料的混合物發生爆炸,隨即引起剩餘一氧化二氮的爆炸性分解。
監管
[編輯]在中華人民共和國,笑氣被列入《危險化學品目錄(2015版)》,其仍可被用作食品添加劑以及醫用麻醉劑。[13]
與環境的關聯
[編輯]氮氧化物,當然也包括一氧化二氮,是一類溫室氣體。因此,氮氧化物是控制溫室氣體排放時(比如京都議定書)的主要對象。一氧化二氮本身是排在二氧化碳、甲烷之後的第三大溫室氣體。它所能造成的溫室效應的效果大約是二氧化碳的200倍[14][15]。在自然條件下,一氧化二氮主要從土壤和海洋中排出。人類耕作、生產、使用氮肥、生產尼龍還有燃燒化石燃料和其他有機物的過程增加了一氧化二氮的排放量。
參考文獻
[編輯]- ^ 陳炳聖. 《萬物簡史》. 源樺. 2007. ISBN 986828421X.
- ^ 東方日報. 潮興吸笑氣京酒吧無王管. 2016-07-21 [2017-05-29]. (原始內容存檔於2021-07-28).
- ^ Keys, T.E. The Development of Anesthesia. Anesthesiology. 1941, 2 (5): 552–574 [2017-08-26]. Bibcode:1982AmSci..70..522D. doi:10.1097/00000542-194109000-00008. (原始內容存檔於2014-01-12).
- ^ Priestley J. Experiments and Observations on Different Kinds of Air 2 (3). 1776 [2017-08-26]. (原始內容存檔於2022-05-12).
- ^ Erving, H. W. The Discoverer of Anæsthesia: Dr. Horace Wells of Hartford.. The Yale Journal of Biology and Medicine. 1933, 5 (5): 421–430. PMC 2606479
 . PMID 21433572.
. PMID 21433572.
- ^ Parmon, V. N.; Panov, G. I.; Uriarte, A.; Noskov, A. S. Nitrous oxide in oxidation chemistry and catalysis application and production. Catalysis Today. 2005, 100 (2005): 115–131. doi:10.1016/j.cattod.2004.12.012.
- ^ Holleman, A. F.; Wiberg, E. Inorganic Chemistry. San Diego: Academic Press. 2001. ISBN 978-0-12-352651-9.
- ^ Nitrous oxide plant. Sanghi Organization. [18 December 2013]. (原始內容存檔於27 November 2013).
- ^ "Nitrogen Family" (頁面存檔備份,存於互聯網檔案館). chemistry.tutorvista.com
- ^ "Preparation of Nitrous Oxide from Urea, Nitric Acid and Sulfuric Acid" (頁面存檔備份,存於互聯網檔案館).
- ^ Suwa T, Matsushima A, Suziki Y, Namina Y. Manufacture of Nitrous Oxide by the Catalytic Oxidation of Ammonia. The Journal of the Society of Chemical Industry, Japan. 1961, 64 (11): 1879–1888. doi:10.1246/nikkashi1898.64.11_1879
 .
.
- ^ Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ^ 年轻人滥用笑气该怎么管?-新华网. 新華網_讓新聞離你更近. 2023-04-13 [2023-09-26]. (原始內容存檔於2023-10-25) (中文).
- ^ Manage the Nitrogen Cycle. NAE Grand Challenges for Engineering. National Academy of Engineering. [2021-04-21]. (原始內容存檔於2022-08-16).
- ^ Nicole Mortillaro. Nitrous oxide, more harmful to the climate than CO2, increasing in atmosphere, study finds [研究發現 : 比起二氧化碳,在大氣中增加的一氧化二氮對氣候影響更大]. 臺灣氣候變遷推估資訊與調適知識平台計劃. 由李宣融翻譯 (CBC News). 2020-10-23 [2022-08-16]. (原始內容存檔於2022-08-16).
外部連結
[編輯]- 從ㄎㄧㄤ掉變癱掉:「毒害」年輕人的笑氣濫用 (頁面存檔備份,存於互聯網檔案館)滲透校園、派對助興,被低估的成癮物質
- 肢體無力竟是吸食「笑氣」!醫:嚴重恐昏迷成植物人、致死 (頁面存檔備份,存於互聯網檔案館)
- 肢體無力 醫師察覺竟是吸食笑氣 長庚呼籲 重視青少年笑氣濫用問題 (頁面存檔備份,存於互聯網檔案館)
- 少女吸「笑氣」神經受損坐輪椅/長庚6年內收治9名青少年患者 最久吸食時間逾6個月 (頁面存檔備份,存於互聯網檔案館)
- 長期吸笑氣恐尿失禁致死 醫籲政府重視青少年濫用問題 (頁面存檔備份,存於互聯網檔案館)
- 吸食笑氣上癮 17歲少女脊髓神經受損,站都站不住 (頁面存檔備份,存於互聯網檔案館)
- 狂吸笑氣成癮 少女神經受損險癱 (頁面存檔備份,存於互聯網檔案館)
- 「笑氣」開趴殺手!1年超過3人猝死 (頁面存檔備份,存於互聯網檔案館)
- Occupational Safety and Health Guideline for Nitrous Oxide
- Paul Crutzen Interview (頁面存檔備份,存於互聯網檔案館) Freeview video of Paul Crutzen Nobel Laureate for his work on decomposition of ozone talking to Harry Kroto Nobel Laureate by the Vega Science Trust.
- National Pollutant Inventory – Oxide of nitrogen fact sheet
- National Institute for Occupational Safety and Health – Nitrous Oxide (頁面存檔備份,存於互聯網檔案館)
- CDC – NIOSH Pocket Guide to Chemical Hazards – Nitrous Oxide (頁面存檔備份,存於互聯網檔案館)
- Nitrous Oxide FAQ (頁面存檔備份,存於互聯網檔案館)
- Erowid article on Nitrous Oxide (頁面存檔備份,存於互聯網檔案館)
- Nitrous oxide fingered as monster ozone slayer (頁面存檔備份,存於互聯網檔案館), Science News
- Dental Fear Central article on the use of nitrous oxide in dentistry (頁面存檔備份,存於互聯網檔案館)










