一氧化二氮
此条目需要补充更多来源。 (2014年1月24日) |
| 一氧化二氮 | |
|---|---|

| |
| |
| |
| IUPAC名 Nitrous oxide 氧化亚氮 | |
| 别名 | 笑气 |
| 识别 | |
| CAS号 | 10024-97-2 |
| PubChem | 948 |
| ChemSpider | 923 |
| SMILES |
|
| InChI |
|
| Beilstein | 8137358 |
| Gmelin | 2153410 |
| UN编号 | 1070(压缩气体) 2201(液体) |
| ChEBI | 17045 |
| RTECS | QX1350000 |
| DrugBank | DB06690 |
| KEGG | D00102 |
| 性质 | |
| 化学式 | N2O |
| 摩尔质量 | 44.0128 g·mol⁻¹ |
| 外观 | 无色气体 |
| 密度 | 1.2228 g/cm3(液态) 1.8 g/L(气态,标准状态) |
| 熔点 | -90.86 °C (182.29 K) |
| 沸点 | -88.48 °C (184.67 K) |
| 溶解性(水) | 0.15 g/100 ml (15 °C) |
| 溶解性 | 易溶于乙醇,醚,硫酸 |
| log P | 0.35 |
| 蒸气压 | 5150 kPa (20 °C) |
| 结构 | |
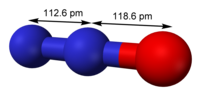
| 分子构型 | 直线型 |
| 偶极矩 | 0.166D |
| 热力学 | |
| ΔfHm⦵298K | +82.05 |
| 药理学 | |
| 妊娠分类 | C(美) |
| 药代动力学: | |
| 5 分钟 | |
| 危险性 | |
| 警示术语 | R:R8 |
| 安全术语 | S:S38 |
| 欧盟编号 | 氧化剂 [O] |
| NFPA 704 | |
| 闪点 | 非易燃 |
| 相关物质 | |
| 相关化学品 | 一氧化氮、二氧化氮、三氧化二氮、四氧化二氮、五氧化二氮、硝酸、亚硝酸 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
一氧化二氮,又称氧化亚氮(英语:Nitrous oxide),俗称笑气,化学式为N2O,是一种无色有甜味气体,在一定条件下能支持燃烧,但在室温下稳定,有轻微麻醉作用,其麻醉作用于1799年由英国化学家汉弗莱·戴维发现[1]。该气体早期被用于牙科手术的麻醉,现用在外科手术和牙科。“笑气”的名称是由于吸入它会感到欣快,并能致人发笑。一氧化二氮能溶于水、乙醇、乙醚及浓硫酸,但不与水反应。它可以用来作为火箭和赛车的氧化剂,以及增加发动机的输出功率。在食品行业中,氧化亚氮可作为添加剂,用于打发奶泡与制作咖啡。一氧化二氮是强温室气体。现笑气被用在很多娱乐场所[2]。
历史
[编辑]一氧化二氮最早是在1772年由英国化学家约瑟夫·普利斯特里合成,他将之称为“燃素的亚硝酸气”[3]。普利斯特里将这一发现写进了他的书《不同类型气体的实验与观察》(1775年),在书中他描述了通过加热铁屑和硝酸的混合物来制备这种气体[4]。
18世纪90年代,汉弗莱·戴维和他的朋友,包括诗人柯尔律治和罗伯特·骚塞试验了这种气体。他们发现一氧化二氮能使病人丧失痛觉,而且吸入后仍然可以保持意识,不会神智不清(现代研究表明吸入过量一氧化二氮后会使人神智不清)。
1844年12月11日,一氧化二氮首次被当作麻醉剂在医学治疗中使用,牙医霍勒斯·威尔士在拔牙过程中使用一氧化二氮减轻病人疼痛[5]。
制备
[编辑]工业生产
[编辑]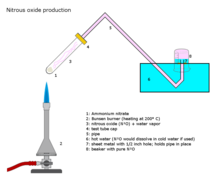
工业上在约250°C的温度下小心加热硝酸铵可以生成一氧化二氮和水蒸汽。[6][7]
添加各种磷酸盐有利于在稍低的温度下形成更纯的气体。该反应可能难以控制,从而导致爆炸。[8]
实验室制备
[编辑]硝酸铵的分解也是制备气体的常用实验室方法。同样也可以通过加热硝酸钠和硫酸铵的混合物制得:[9]
另一种方法涉及尿素、硝酸和硫酸的反应:[10]
据报道,可用二氧化锰-三氧化二铋催化剂直接氧化氨:[11]参考奥斯特瓦尔德法。
盐酸羟胺与亚硝酸钠反应生成一氧化二氮。如果将亚硝酸盐添加到羟胺溶液中,则唯一剩余的副产物是盐水。但是,如果将羟胺溶液添加到亚硝酸盐溶液中(亚硝酸盐过量),则会形成有毒的高级氮氧化物:
连二次硝酸会分解为一氧化二氮和水,在25°C,pH值1–3时的半衰期为16天。 [12]
结构与性质
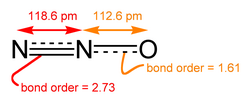
[编辑]一氧化二氮的分子是直线型结构。其中一个氮原子与另一个氮原子相连,而第二个氮原子又与氧原子相连。它可以被认为是
- 和
的共振杂化体。
一氧化二氮可以被氧化为更高价的氮氧化物,如一氧化氮NO和二氧化氮NO2。
将一氧化二氮与沸腾汽化的碱金属反应可以生成一系列的亚硝酸盐,在高温下,一氧化二氮也可以氧化有机物。
应用
[编辑]一氧化二氮是一种助燃剂,最初用在帮助二战时德军飞机迅速逃离战场,现今用于改装汽车上,用于直线加速。
增加车辆速度
[编辑]使用氮氧加速系统的改装车辆将一氧化二氮送入引擎,遇热分解成氮气和氧气,提高引擎燃烧率,增加速度。氧气有助燃作用,加快燃料燃烧。
火箭氧化剂
[编辑]一氧化二氮可以用作火箭氧化剂。比其他氧化剂更好的地方是因为它是无毒的,在室温下稳定,易于储存和相对安全地进行飞行。第二个好处是可以很容易分解成帮助呼吸的空气。
用作麻醉剂
[编辑]医生会让病人吸入一氧化二氮和氧气,以降低对疼痛的感觉,同时让病人在清醒状态。
食品加工
[编辑]因不易与奶油中的成分发生反应,多用做奶油发泡剂。
安全性
[编辑]人可能因为在吸入笑气时氧气过少而引起突然的窒息。暴露于笑气中会短时间导致智力,视听能力,手的灵活度降低。长期接触可引起维生素B群缺乏症,肌肉麻痹等。
一氧化二氮的主要安全隐患在于,它是一种有分解性的麻醉剂,而且通常以加压液化的形式储存。在正常储存时,它是很稳定的,使用起来也很安全。但是如果错误地使用,它会很容易分解而且很有可能爆炸。液态的一氧化二氮是有机物的良好溶剂,不过用它制成溶液有可能会生成一些对外界刺激敏感的爆炸性物质。一部分火箭事故由于一氧化二氮被燃料污染而发生,少量的一氧化二氮和燃料的混合物发生爆炸,随即引起剩余一氧化二氮的爆炸性分解。
监管
[编辑]在中华人民共和国,笑气被列入《危险化学品目录(2015版)》,其仍可被用作食品添加剂以及医用麻醉剂。[13]
与环境的关联
[编辑]氮氧化物,当然也包括一氧化二氮,是一类温室气体。因此,氮氧化物是控制温室气体排放时(比如京都议定书)的主要对象。一氧化二氮本身是排在二氧化碳、甲烷之后的第三大温室气体。它所能造成的温室效应的效果大约是二氧化碳的200倍[14][15]。在自然条件下,一氧化二氮主要从土壤和海洋中排出。人类耕作、生产、使用氮肥、生产尼龙还有燃烧化石燃料和其他有机物的过程增加了一氧化二氮的排放量。
参考文献
[编辑]- ^ 陈炳圣. 《萬物簡史》. 源桦. 2007. ISBN 986828421X.
- ^ 东方日报. 潮興吸笑氣京酒吧無王管. 2016-07-21 [2017-05-29]. (原始内容存档于2021-07-28).
- ^ Keys, T.E. The Development of Anesthesia. Anesthesiology. 1941, 2 (5): 552–574 [2017-08-26]. Bibcode:1982AmSci..70..522D. doi:10.1097/00000542-194109000-00008. (原始内容存档于2014-01-12).
- ^ Priestley J. Experiments and Observations on Different Kinds of Air 2 (3). 1776 [2017-08-26]. (原始内容存档于2022-05-12).
- ^ Erving, H. W. The Discoverer of Anæsthesia: Dr. Horace Wells of Hartford.. The Yale Journal of Biology and Medicine. 1933, 5 (5): 421–430. PMC 2606479
 . PMID 21433572.
. PMID 21433572.
- ^ Parmon, V. N.; Panov, G. I.; Uriarte, A.; Noskov, A. S. Nitrous oxide in oxidation chemistry and catalysis application and production. Catalysis Today. 2005, 100 (2005): 115–131. doi:10.1016/j.cattod.2004.12.012.
- ^ Holleman, A. F.; Wiberg, E. Inorganic Chemistry. San Diego: Academic Press. 2001. ISBN 978-0-12-352651-9.
- ^ Nitrous oxide plant. Sanghi Organization. [18 December 2013]. (原始内容存档于27 November 2013).
- ^ "Nitrogen Family" (页面存档备份,存于互联网档案馆). chemistry.tutorvista.com
- ^ "Preparation of Nitrous Oxide from Urea, Nitric Acid and Sulfuric Acid" (页面存档备份,存于互联网档案馆).
- ^ Suwa T, Matsushima A, Suziki Y, Namina Y. Manufacture of Nitrous Oxide by the Catalytic Oxidation of Ammonia. The Journal of the Society of Chemical Industry, Japan. 1961, 64 (11): 1879–1888. doi:10.1246/nikkashi1898.64.11_1879
 .
.
- ^ Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ^ 年轻人滥用笑气该怎么管?-新华网. 新华网_让新闻离你更近. 2023-04-13 [2023-09-26]. (原始内容存档于2023-10-25) (中文).
- ^ Manage the Nitrogen Cycle. NAE Grand Challenges for Engineering. National Academy of Engineering. [2021-04-21]. (原始内容存档于2022-08-16).
- ^ Nicole Mortillaro. Nitrous oxide, more harmful to the climate than CO2, increasing in atmosphere, study finds [研究发现 : 比起二氧化碳,在大气中增加的一氧化二氮对气候影响更大]. 台湾气候变迁推估资讯与调适知识平台计划. 由李宣融翻译 (CBC News). 2020-10-23 [2022-08-16]. (原始内容存档于2022-08-16).
外部链接
[编辑]- 从ㄎㄧㄤ掉变瘫掉:“毒害”年轻人的笑气滥用 (页面存档备份,存于互联网档案馆)渗透校园、派对助兴,被低估的成瘾物质
- 肢体无力竟是吸食“笑气”!医:严重恐昏迷成植物人、致死 (页面存档备份,存于互联网档案馆)
- 肢体无力 医师察觉竟是吸食笑气 长庚呼吁 重视青少年笑气滥用问题 (页面存档备份,存于互联网档案馆)
- 少女吸“笑气”神经受损坐轮椅/长庚6年内收治9名青少年患者 最久吸食时间逾6个月 (页面存档备份,存于互联网档案馆)
- 长期吸笑气恐尿失禁致死 医吁政府重视青少年滥用问题 (页面存档备份,存于互联网档案馆)
- 吸食笑气上瘾 17岁少女脊髓神经受损,站都站不住 (页面存档备份,存于互联网档案馆)
- 狂吸笑气成瘾 少女神经受损险瘫 (页面存档备份,存于互联网档案馆)
- “笑气”开趴杀手!1年超过3人猝死 (页面存档备份,存于互联网档案馆)
- Occupational Safety and Health Guideline for Nitrous Oxide
- Paul Crutzen Interview (页面存档备份,存于互联网档案馆) Freeview video of Paul Crutzen Nobel Laureate for his work on decomposition of ozone talking to Harry Kroto Nobel Laureate by the Vega Science Trust.
- National Pollutant Inventory – Oxide of nitrogen fact sheet
- National Institute for Occupational Safety and Health – Nitrous Oxide (页面存档备份,存于互联网档案馆)
- CDC – NIOSH Pocket Guide to Chemical Hazards – Nitrous Oxide (页面存档备份,存于互联网档案馆)
- Nitrous Oxide FAQ (页面存档备份,存于互联网档案馆)
- Erowid article on Nitrous Oxide (页面存档备份,存于互联网档案馆)
- Nitrous oxide fingered as monster ozone slayer (页面存档备份,存于互联网档案馆), Science News
- Dental Fear Central article on the use of nitrous oxide in dentistry (页面存档备份,存于互联网档案馆)










