2-降冰片基碳正離子
| 2-降冰片基碳正離子 | |
|---|---|

| |
| 識別 | |
| CAS編號 | 24321-81-1 |
| 性質 | |
| 化學式 | C 7H 11+ |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
2-降冰片基碳正離子(英語:2-Norbornyl cation,IUPAC命名法為2-雙環[2.2.1]庚基陽離子)是降冰片烷的三種碳正離子中間體之一,化學式為C
7H
11+。
2-降冰片基離子的3c-2e非經典碳正離子假想結構最早由Saul Winstein在1949年提出[1],其後圍繞非經典碳正離子結構之爭持續了約半個世紀,直至2013年F. Scholz等人通過低溫XRD確定了降冰片基正離子的非經典離子晶體結構[2],才最後為其「蓋棺論定」。時至今日,學界普遍都認可2-降冰片基碳正離子的非經典結構,但也意識到,某一離子的經典結構與非經典結構間轉換的能壘可能並不大,如一些烷基取代的2-降冰片基衍生物同樣會採取經典結構[3]。
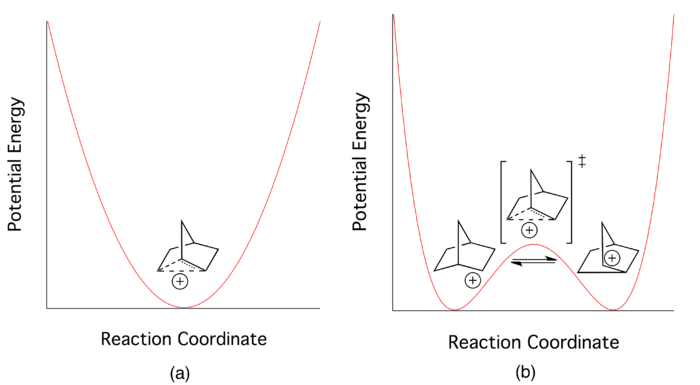
理論
[編輯]在20世紀中葉,關於2-降冰片基陽離子的鍵合形式,學界進行了多次激烈而著名的爭論,一方提出非經典碳正離子理論,儘管該理論在當時缺乏直接的實驗依據支撐,但有相當數量的有機化學家非常輕易地接納了這一理論;一方則批評其理論的「軟性」,並認為在進一步的事實證據出現前,2-降冰片基碳正離子應該通過一對快速平衡的經典結構來解釋,二者在當時各有擁躉。不過即便在理論上有爭辯,大多數化學家都認同2-降冰片基陽離子中存在電子離域。研究人員們試圖通過新方法找到一個低能量的過渡態(即多維勢能面上的鞍點)或其本身的能量最低點,支持經典理論的一方認為,雙勢阱模型是「最適配」的解釋,其中可能存在一個能量略高的過渡態;支持非經典理論的一方認為,反應中的勢能最低點處即是非經典結構的陽離子[4]。因此,兩方爭論的核心也就演變成了,非經典碳正離子究竟是一個反應過渡態,還是一個可分離的中間體。
非經典結構之共振論
[編輯]2-降冰片基碳正離子被認為是最具代表性的非經典碳正離子,所謂非經典碳正離子是指一類有機陽離子,其中包含一個三中心兩電子鍵,同時有σ鍵和π鍵參與[5]。一些簡單的有機陽離子,如質子化的乙炔(乙炔基陽離子,C
2H+
3)、質子化的乙烯(乙烯基陽離子,C
2H+
5)和質子化的乙烷(乙基陽離子,C
2H+
7),已有紅外光譜學研究描述了其非經典陽離子的結構[6]。

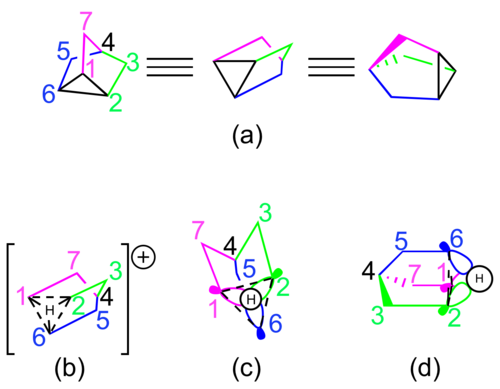
非經典結構理論的支持者們通常願意用共振式或帶虛線鍵的超價結構來表示2-降冰片基碳正離子(圖2)。該超價結構可以被拆分為:C1-C6間的部分σ鍵、C2-C6間的部分σ鍵和C1-C2間的部分π鍵,對應了三種共振結構[7]。

關於π鍵結構的共振式對離域電子結構的實際貢獻曾有爭議[9],但通過1H和13C NMR光譜證實了C6上存在少量正電荷[10];也有報道稱可以通過β-(Δ3-環戊烯基)-乙烷的酯衍生物來構建2-降冰片基陽離子結構,證明了含π鍵的共振結構是重要的[11]。
以分子軌域理論來理解2-降冰片基陽離子(圖3),可以認為該超價鍵由C1、C2上的p軌域和C6上的一個sp3組成[8][12]。對2-降冰片基陽離子的擴展休克耳方法分子軌域計算結果表明,C6上的軌域可能是sp2混成的,但這只會影響其上偕氫的幾何形狀[13]。
經典結構之快速平衡論
[編輯]
經典結構的支持者們認為,通過兩個不對稱對映體的快速平衡,就可以不打破經典結構而解釋降冰片基陽離子的穩定性,Wagner-Meerwein重排反應被援引用以支持此觀點。該理論的解釋雖然符合溶劑解反應速率的結果,不過分離這兩個對映體的努力全部付諸東流。有報道指出是由於2-降冰片基衍生物的溶劑解反應中極快的正向與逆向反應速率,也側面表明了兩個對映體間轉化的能壘非常低[7]。
其他理論
[編輯]1951年有人提出,降三環烯基陽離子[註 1]是更能代表2-降冰片基陽離子的非經典離子結構,這是一個C3對稱的降三環烯[註 2]離子。這種結構最早被用來部分解釋14C同位素標記實驗的結果[14]。分子軌域表示該結構包含C1、C2和C6的sp2混成軌域與共用氫原子上1s軌域間的同相相互作用[15]。
歷史
[編輯]引入概念
[編輯]非經典碳正離子與傳統陽離子的電子結構不同,經典的化學鍵被理解為兩個原子共享一對電子,但在穩定的非經典碳正離子中則是三個(或更多)原子共享一對電子[5]。在1939年,Thomas Nevell等人試圖闡明莰烯鹽酸鹽轉化為氯代異冰片的機理。該論文中擬議的一個機理中,描述了一個中間體的陽離子電荷沒有依附於某個原子,而是分配到了整體結構上[16]。該研究被認為是有機化學歷史上首次引出非經典碳正離子的概念[17]。不過,非經典離子這一術語,則是直到12年後才被使用,在一篇研究烯丙基卡賓互變異構中間體的研究中被用以表示一個三角錐形的丁基陽離子中的離域鍵[18]。在早期研究階段,有研究者猜測此類型的陽離子鍵合方式與硼烷相似[19]。
早期發展
[編輯]1949年,Saul Winstein發現外型-2-對溴苯磺酸降冰片酯和內型-2-對甲苯磺酸降冰片酯在乙醯解[註 3]反應中得到了相同的外消旋混合產物——外型-2-降冰片基乙酸鹽(圖6)。鑑於Bs與Ts的離去速率接近,Winstein提出內/外型-2-降冰片基均通過相同的碳正離子中間體發生溶劑解反應,並且這個中間體可能是對稱、離域的2-降冰片基碳正離子。[1]之後的氣相色譜研究表明,該反應產物的內型差向異構物含量低於0.02 %,證明了該反應的高度立體選擇性 [20]。


Winstein認為在離去基團離去後,外型底物更易於形成對稱的中間體陽離子,因此親核試劑能從兩端同時進攻,得到外消旋的產物[1]。實驗中還發現外型底物的溶劑解速率比內型底物的要快350倍,被解釋為外型的C1- C6σ鍵的鄰助效應,幫助形成了具對稱面的中間體[1]。該理論被後世認為是對非經典碳正離子的確切闡釋,也使得許多有機化學家相信2-降冰片基碳正離子的穩定性正是基於其對稱且非經典的橋環結構(並藉此推廣出了許多更複雜的非經典離子);也有一些作者選擇通過其他理論來解釋這一特殊穩定性[3]。
異議漸起
[編輯]儘管非經典碳正離子在許多化學家眼中是完美的理論,赫伯特·布朗卻認為引入一種缺乏依據的新型鍵合方式是多此一舉。布朗批評非經典碳正離子理論的支持者們忽視過去對反應性的解釋,並認為上述的「反常」現象都可以通過簡單的立體效應來解釋[7]。他認為使用一對快速平衡的對映體,便可以解釋此碳正離子的高反應性、內外型溶劑解速率差異和產物立體選擇性等諸多現象,因而沒有必要使用一個新的理論[21]。布朗認為這一做法對整個化學界發展而言是適得其反,並且也的確有許多相關論文因不切實際而被退回[4]。這一觀點自1962年提出後,引發了許多爭議,布朗也開始尋找實驗證據支撐自己的觀點[22]。
布朗還嘗試證明2-降冰片基碳正離子離域的不穩定性,並嘗試論證將離域結構看作是兩個不對稱陽離子間的過渡態[4][23]。儘管他並不反對離域過渡態的可能性,但即使是在其研究事業的晚期,布朗仍堅持拒絕認可2-降冰片基陽離子的鏡面對稱性 [24]。
總體影響
[編輯]2-降冰片基碳正離子所引述的3c-2e鍵讓化學家們著眼於探索全新的化學鍵領域,他們急於將新的超價理論套進舊的系統和新的發現中,而在這一過程中也出現了許多不夠嚴謹的研究[9]。圍繞非經典離子的研究中,觸及了一個最根本的基礎概念,即已成σ鍵的電子所表現出的反應性。雖然人們早就知道π軌域能作為電子供體參與反應,但卻缺乏理論和實驗依據來證明σ軌域具有相同的功能。2-降冰片基陽離子的非經典結構可以被看作是一個σ鍵的電子對被提供給了碳正離子上的空p軌域,許多研究實質上是寄希望於此來開拓有機化學的新理論[25][26]。
布朗與非經典離子理論支持者的激烈爭論也極大地推動了該領域發展,為了駁斥對方的觀點,雙方都竭盡所能地尋找新的表徵技術和對現有數據進行建模[27]。隨著超酸的應用和低溫核磁共振分析方法的進步,使人們可以掌握非經典離子結構的更多數據[3]。2-降冰片基陽離子的過渡態和離域假說,促使人們對過渡態進行更頻繁的研究,極大地提高了學界對其電子結構的理解[27]。
合成
[編輯]2-降冰片基碳正離子可以通過三種途徑合成:σ-途徑、π-途徑和β-Δ3-途徑。

σ途徑
[編輯]此途徑的起始材料是外型的2-降冰片衍生物,在強酸性條件下,鄰近σ鍵的電子被提供給離去基團和C2上的σ*軌域(圖8a)[28]。
如果底物的離去基團處於內型位置,那麼這一過程機理相比外型要慢得多,可能有缺乏σ軌域鄰助效應的原因,此構型的離去基團可以發生SN2反應,如果反應體系中還存在高濃度的親電體,那麼會因競爭反應而產生構型反轉的產物[1][29]。
π途徑
[編輯]此途徑的起始材料是β-(Δ3-環戊烯基)乙烷衍生物,離去基團位於乙基末端位置,π軌域中的電子填充到末端碳原子和離去基團間的σ*軌域(圖8c)[28][29]。例如,對硝基苯磺酸-β-(Δ3-環戊烯基)乙酯的乙醯解主要產物是外型-2-降冰片酯,只有少量β-(Δ3-環戊烯基)乙酸乙酯產物,原因是非經典離子結構比取代的環戊烯結構更加穩定[11]。
此路線要求底物中的雙鍵(環戊烯基)獨立於其他的π鍵系統,如果雙鍵同時參與了芳香環離域,如對硝基苯磺酸-2-茚滿乙基酯,反應速率就會顯著地降低[30]。
幾何結構
[編輯]光譜研究
[編輯]鑑於2-降冰片基陽離子的三種假想結構都表現出至少一種不同的對稱性,Olah等人嘗試從分子對稱性切入,來檢驗2-降冰片基碳正離子的非經典結構,如核磁共振光譜、拉曼光譜等。在氟銻酸鹽環境下,早期核磁共振光譜只有一個寬峰,表明其上氫原子是化學等效的,證明了在室溫下的穩定2-降冰片基陽離子中氫遷移速度較快。隨著更精細和低溫的核磁共振技術發展,才逐漸從中解出更多的結構信息,在低溫下的氫核磁共振光譜基本與非經典離子結構的預期相符[31][32]。
低溫核磁共振光譜發現,2-降冰片基陽離子的互變異構信號逐漸「被凍結」 [33],但即使在-156 ℃下仍能觀察到2-降冰片基陽離子的Wagner-Meerwein重排反應(1,2-碳遷移)的分裂信號,其速度都快於NMR實驗的最小尺度[34][35]。不過,當時的低溫NMR研究沒有證明或證偽這兩個理論[10]。80年代的固體NMR分析發現,5 K(-268 ℃)下2-降冰片基碳正離子固體的13C譜圖中,沒有發現C1、C2峰分裂的信號,這表明要麼2-降冰片基陽離子中存在活化能極低的平衡反應,要麼就是非經典碳正離子理論的勝利[36]。
2-降冰片基碳正離子的拉曼光譜展現出更對稱的結構,由於假想的平衡重排反應速率低於拉曼光譜的尺度,如果經典結構是正確的,應該會出現不太對稱的拉曼光譜[9]。
一些13C核磁共振研究者傾向於用降三環烯基陽離子結構來解釋[37]。在強酸性環境中的拉曼光譜在3110 cm-1處的吸收帶被認為是缺電子的環丙烷環,一部分研究者將其作為降三環烯結構的證據[38]。其他化學家推測,2-降冰片基碳正離子的特性可能非常依賴溶劑環境,在強酸性、低親核性的環境下降三環烯基陽離子的幾何形成可能是最穩定的,而在其他環境中則未必如此[9]。
計算研究
[編輯]許多計算研究被用來驗證可能的幾何結構,採用MINDO/3半經驗方法,沒有得出哪種2-降冰片基碳正離子的幾何結構在能量上是有利的。然而,2-甲基-2-降冰片基碳正離子的經典結構被發現是唯一的可能最低值[39]。而通過拓展休克耳方法進行分子軌域計算結果有利於具反射對稱性的非經典離子結構[13][40]。
熱力學
[編輯]有研究基於2-降冰片基碳正離子的離域性,比較了其烷基衍生物的熱力學穩定性。通過比較2/3-甲基-2-降冰片基碳正離子與異戊烷仲/三級碳正離子間的重排反應,發現降冰片系統的焓變要低6 kcal/mol。由於這二種可逆重排反應的主要差別是電子組態時可能發生的離域,似乎可以把降冰片系統的特殊性歸因於其非經典結構[41]。不過,有研究指出未能在溶劑解反應中觀察到此類穩定化能[4]。
其他對於2-降冰片基碳正離子的穩定性研究表明,C1、C2的烷基取代會使該離子變為經典結構[42],三級碳比二級碳要穩定的多,因此不需要採取離域便可以轉變為最低勢能的結構[43]。
動力學
[編輯]Winstein和Trifan首先提出動力學證據來提出非經典碳正離子,他們推斷在反應中存在非經典結構的離子以解釋內外型反應速率差異[1]。其後有其他研究調查了可能同樣提供σ鄰助效應的非降冰片系統的化合物,發現有相似的反應速率變快的趨勢,一些報告也將此作為非經典離子的證據[44]。布朗為代表的的其他研究者則不同意這一點,他們發現在結構上與降冰片體系類似的環戊烷衍生物也具有提升反應速率的特點,並由此作為經典結構的論據[45][46]。
同位素標記實驗
[編輯]
研究人員們在放射性同位素標記實驗中找到了非經典結構離域鍵的證據(圖9),非經典結構的支持者預期在2-降冰片基離子的分解反應中含有50%的含14C的CO2,而經典結構理論的支持者則認為,由於過渡態短壽的特點,分解的CO2中會含有更多的放射性原子。而觀察到的CO2中約有40%的含放射性,更偏向於非經典結構理論[15]。
將氫核磁共振與同位素標記相結合,進一步支持了非經典離子理論。2-降冰片基碳正離子上不對稱位置的氘標記將使得研究者們能通過分析譜圖上分裂的峰,將碳原子分為2或3組等效位置。如果該系統中存在快速平衡,那麼相關位置的峰值會出現顯著的分裂(10-100ppm);如果該系統是「靜態」的,那麼該分裂則很微小[47][48]。2-降冰片基陽離子在-150 ℃左右的13C NMR譜圖表明,C1、C2處的分裂小於10ppm,印證了非經典離子的理論[49]。
X射線晶體學
[編輯]2-降冰片基碳正離子晶體結構的測定是非經典結構的直接證據,不過卻沒有製得標準狀況下的晶體。近期,Scholz等人通過對2-降冰片基碳正離子的七溴合二鋁酸鹽在低溫下進行XRD,確定了[C
7H
11]+[Al
2Br
7]−·CH
2Br
2的晶體結構[2]。
為了排除單晶相變時原子取向無序的影響,該報道指出在86 K時單晶結構會經歷有序-無序的轉化過程,通過仔細的退火操作,在40 K時的有序相中收集到了三個晶體學獨立的2-降冰片基非經典離子結構。研究人員還發現,C6和C1、C2間的鍵長略長於典型的烷烴σ鍵[2]。
腳註
[編輯]參見
[編輯]參考文獻
[編輯]- ^ 1.0 1.1 1.2 1.3 1.4 1.5 Winstein, S.; Trifan, D. S. The Structure of the Bicyclo[2,2,1]2-Heptyl (Norbornyl) Carbonium Ion. Journal of the American Chemical Society. 1949, 71 (8): 2953. doi:10.1021/ja01176a536.
- ^ 2.0 2.1 2.2 Scholz, F.; Himmel, D.; Heinemann, F. W.; Schleyer, P. V. R.; Meyer, K.; Krossing, I. Crystal Structure Determination of the Nonclassical 2-Norbornyl Cation. Science. 2013, 341 (6141): 62–64. Bibcode:2013Sci...341...62S. PMID 23828938. S2CID 206549219. doi:10.1126/science.1238849.
- ^ 3.0 3.1 3.2 Walling, C. An innocent bystander looks at the 2-norbornyl cation. Accounts of Chemical Research. 1983, 16 (12): 448–454. doi:10.1021/ar00096a004.
- ^ 4.0 4.1 4.2 4.3 Brown, H. C. The energy of the transition states and the intermediate cation in the ionization of 2-norbornyl derivatives. Where is the nonclassical stabilization energy?. Accounts of Chemical Research. 1983, 16 (12): 432–440. doi:10.1021/ar00096a002.
- ^ 5.0 5.1 Sargent, G. D. Bridged, non-classical carbonium ions. Quarterly Reviews, Chemical Society. 1966, 20 (2): 301–1073. doi:10.1039/QR9662000301.
- ^
Yeh, L. I.; Price, J. M.; Lee, Y. T. Infrared spectroscopy of the pentacoordinated carbonium ion C
2H+
7. Journal of the American Chemical Society. 1989, 111 (15): 5597. doi:10.1021/ja00197a015. - ^ 7.0 7.1 7.2 Brown, H. C. Question of σ Bridging in the solvolysis of 2-norbornyl derivatives. Accounts of Chemical Research. 1973, 6 (11): 377–386. doi:10.1021/ar50071a003.
- ^ 8.0 8.1
Streitwieser, Andrew. Chapter 12: Carbonium Ions. Molecular Orbital Theory for Organic Chemists
 . New York: John Wiley and Sons Inc. 1961: 357–391.
. New York: John Wiley and Sons Inc. 1961: 357–391.
- ^ 9.0 9.1 9.2 9.3 Sargent, George Dann. Chapter 24: The 2-Norbornyl Cation. Olah, George; von Schleyer, Paul (編). Carbonium Ions. Volume III: Major Types (Continued). New York: Wiley-Interscience: 1099–1200. 1971.
- ^ 10.0 10.1 Olah, G. A.; Liang, G.; Mateescu, G. D.; Riemenschneider, J. L. Stable carbocations. CL. Fourier transform carbon-13 nuclear magnetic resonance and x-ray photoelectron spectroscopic study of the 2-norbornyl cation. Journal of the American Chemical Society. 1973, 95 (26): 8698. doi:10.1021/ja00807a032.
- ^ 11.0 11.1 Lawton, R. G. 1,5-Participation in the solvolysis of β-(Δ3-cyclopentenyl)ethyl p-nitrobenzenesulfonate. Journal of the American Chemical Society. 1961, 83 (10): 2399. doi:10.1021/ja01471a047.
- ^ Olah, G. A.; Mateescu, G. D.; Riemenschneider, J. L. Electron spectroscopy of organic ions. II. Carbon 1s electron binding energies of the norbornyl, 2-methylnorbornyl, and related cations. Differentiation between nonclassical carbonium and classical carbenium ions. Journal of the American Chemical Society. 1972, 94 (7): 2529. doi:10.1021/ja00762a066.
- ^ 13.0 13.1 Trahanovsky, W. S. Molecular Orbital Calculations of the Norbornyl Cation Using an Extended Hückel Theory. The Journal of Organic Chemistry. 1965, 30 (5): 1666–1668. doi:10.1021/jo01016a517.
- ^ J. D. Roberts and C. C. Lee. The nature of the intermediate in the solvolysis of norbornyl derivatives. J. Am. Chem. Soc. 1951, 73 (10): 5009–5010. doi:10.1021/ja01154a555.
- ^ 15.0 15.1 15.2 Roberts, J. D.; Lee, C. C.; Saunders, W. H. Rearrangements in Carbonium Ion-Type Reactions of C14-Labeled Norbornyl Derivatives. Journal of the American Chemical Society. 1954, 76 (18): 4501. doi:10.1021/ja01647a001.
- ^ Nevell, T. P.; De Salas, E.; Wilson, C. L. 259. Use of isotopes in chemical reactions. Part I. The mechanism of the Wagner–Meerwein rearrangement. Exchange of radioactive chlorine and of deuterium between camphene hydrochloride and hydrogen chloride. Journal of the Chemical Society (Resumed). 1939: 1188–1199. doi:10.1039/JR9390001188.
- ^ Brown, H. C.; Liu, K. T. Additions to bicyclic olefins. VII. Electrophilic additions of hydrogen chloride and deuterium chloride to norbornene, 2-methylenenorbornane, and related bicyclic olefins. Evidence for a carbonium ion process and the capture of unsymmetrical (classical) 2-norbornyl cations. Journal of the American Chemical Society. 1975, 97 (3): 600. doi:10.1021/ja00836a022.
- ^ Roberts, J. D.; Mazur, R. H. The Nature of the Intermediate in Carbonium Ion-Type Interconversion Reactions of Cyclobutyl, Cyclopropylcarbinyl and Allylcarbinyl Derivatives. Journal of the American Chemical Society. 1951, 73 (7): 3542. doi:10.1021/ja01151a550.
- ^ Brown, F.; Hughes, E. D.; Ingold, C. K.; Smith, J. F. Wagner Changes, Synartetic Acceleration and Synartetic Ions. Nature. 1951, 168 (4263): 65. Bibcode:1951Natur.168...65B. S2CID 4283069. doi:10.1038/168065a0.
- ^ Winstein, S.; Clippinger, E.; Howe, R.; Vogelfanger, E. The Nonclassical Norbornyl Cation. Journal of the American Chemical Society. 1965, 87 (2): 376. doi:10.1021/ja01080a040.
- ^ Brown, Herbert. Strained Transition States. Special Publication. No. 16: The Transition State. London: The Chemical Society: 140–178. 1962.
- ^ Brown, H. C.; Chloupek, F. J.; Rei, M. H. Synthesis and Rates of Ethanolysis of 2-Phenyl-exo-norbornyl Chloride. The Question of a Nonclassical 1- and 2-Phenylnorbornyl Cation. Journal of the American Chemical Society. 1964, 86 (6): 1246. doi:10.1021/ja01060a058.
- ^ Brown, H. C.; Morgan, K. J.; Chloupek, F. J. Structural Effects in Solvolytic Reactions. I. The Role of Equilibrating Cations in Carbonium Ion Chemistry. Nature of the Intermediates Involved in the Solvolysis of Symmetrically Substituted β-Phenylethyl Derivatives. Journal of the American Chemical Society. 1965, 87 (10): 2137. doi:10.1021/ja01088a011.
- ^ Brown, H. C. Correspondence – the 2-norbornyl cation revisited. Accounts of Chemical Research. 1986, 19 (2): 34. doi:10.1021/ar00122a001.
- ^ Olah, G. A. Stable carbocations, 189. The σ-bridged 2-norbornyl cation and its significance to chemistry. Accounts of Chemical Research. 1976, 9 (2): 41–52. doi:10.1021/ar50098a001.
- ^ Olah, G. A.; Prakash, G. K. S.; Saunders, M. Conclusion of the classical-nonclassical ion controversy based on the structural study of the 2-norbornyl cation. Accounts of Chemical Research. 1983, 16 (12): 440. doi:10.1021/ar00096a003.
- ^ 27.0 27.1 Olah, G. A. My Search for Carbocations and Their Role in Chemistry(Nobel Lecture). Angewandte Chemie International Edition in English. 1995, 34 (1314): 1393–1405. doi:10.1002/anie.199513931.
- ^ 28.0 28.1 Winstein, S.; Carter, P. The π-Route to a Bicycloöctyl Non-Classical Cation. Journal of the American Chemical Society. 1961, 83 (21): 4485. doi:10.1021/ja01482a057.
- ^ 29.0 29.1 Nenitzescu, Costin. Chapter 1: Historical Outlook. Olah, George; von Schleyer, Paul (編). Carbonium Ions. Volume I: General Aspects and Methods of Investigation. New York: Wiley-Interscience: 55–59. 1968.
- ^ Bartlett, P. D.; Sargent, G. D. Nucleophilic Reactivity of the Carbon–Carbon Double Bond. II. Solvolytic Ring Closure of 2-(3-methyl- and 3,4-dimethyl-Δ3-cyclopentenyl)ethyl p-nitrobenzenesulfonates. Journal of the American Chemical Society. 1965, 87 (6): 1297. doi:10.1021/ja01084a026.
- ^ Schleyer, P. V. R.; Watts, W. E.; Fort, R. C.; Comisarow, M. B.; Olah, G. A. Stable Carbonium Ions. X. Direct Nuclear Magnetic Resonance Observation of the 2-Norbornyl Cation. Journal of the American Chemical Society. 1964, 86 (24): 5679. doi:10.1021/ja01078a056.
- ^ Olah, G. A.; Prakash, G. K. S.; Arvanaghi, M.; Anet, F. A. L. High-Field 1H and 13C NMR Spectroscopic Study of the 2-Norbornyl Cation. Journal of the American Chemical Society. 1982, 104 (25): 7105. doi:10.1021/ja00389a037.
- ^ Leone, Ronald; Barborak, J.C.; von Schleyer, Paul. Chapter 33: Degenerate Carbonium Ions. Olah, George; von Schleyer, Paul (編). Carbonium Ions. Volume IV: Major Types (Continued). New York: Wiley-Interscience: 1911–1915. 1973.
- ^ Fry, James; Karabatsos, Gerasimos. Chapter 14: Intramolecular Hydride Shifts in Carbonium Ions. Olah, George; von Schleyer, Paul (編). Carbonium Ions. Volume II: Methods of Formation and Major Types. New York: Wiley-Interscience: 535–553. 1970.
- ^ Olah, G. A. Chemischer Informationsdienst 7 (24). 1976.
- ^ Yannoni, C. S.; Macho, V.; Myhre, P. C. Resolved 13C NMR spectra of carbonium ions at cryogenic temperatures. The norbornyl cation at 5 K. Journal of the American Chemical Society. 1982, 104 (25): 7380. doi:10.1021/ja00389a108.
- ^ Olah, G. A.; White, A. M. Stable carbonium ions. LXXXVI. Carbon-13 nuclear magnetic resonance spectrum of the stable nonclassical norbornyl cation. Incompatibility with the equilibrating classical ion conception and further proof for the protonated nortricyclene structure. Journal of the American Chemical Society. 1969, 91 (14): 3954. doi:10.1021/ja01042a053.
- ^ Olah, G. A.; Commeyras, A.; Lui, C. Y. Stable carbonium ions. LXXII. Raman and N.M.R. Spectroscopic study of the nortricyclonium ion [protonated tricyclo[2.2.1.02,6]heptane] and its relation to the 2-norbornyl [bicyclo[2.2.1]heptyl] cation. The nature of the stable long-lived norbornyl cation in strong acid solutions. Journal of the American Chemical Society. 1968, 90 (14): 3882. doi:10.1021/ja01016a062.
- ^ Radom, Leo; Poppinger, Dieter; Haddon, Robert. Chapter 38: Molecular Orbital Theory of Carbocations. Olah, George; von Schleyer, Paul (編). Carbonium Ions. Volume V: Miscellaneous Ions, Theory, and Structure. New York: Wiley-Interscience: 2390–2391. 1976.
- ^ Hoffmann, R. Extended Hückel Theory. IV. Carbonium Ions. The Journal of Chemical Physics. 1964, 40 (9): 2480–2488. Bibcode:1964JChPh..40.2480H. doi:10.1063/1.1725551.
- ^ Schleyer, P. V. R.; Chandrasekhar, J. Evaluation of the extra stability of the bridged 2-norbornyl cation. The Journal of Organic Chemistry. 1981, 46: 225–227. doi:10.1021/jo00314a065.
- ^ Brown, H. C.; Rei, M. H. Comparison of the Effect of Substituents at the 2-Position of the Norbornyl System with Their Effect in Representative Secondary Aliphatic and Alicyclic Derivatives. Evidence for the Absence of Nonclassical Stabilization of the Norbornyl Cation. Journal of the American Chemical Society. 1964, 86 (22): 5008. doi:10.1021/ja01076a058.
- ^ Bunton, C.A. Chapter 2. Structural Effects upon Rate of Substitution; Section 11. Non-classical carbonium ions. Hughes, E.D. (編). Reaction Mechanisms in Organic Chemistry. Volume I: Nucleophilic Substitution at a Saturated Carbon Atom. Amsterdam: Elsevier Publishing Company. 1963: 59–67.
- ^ Schleyer, P. V. R. The Nonclassical Carbonium Ion Problem: Reaction Rates. Journal of the American Chemical Society. 1964, 86 (9): 1856–1857. doi:10.1021/ja01063a044.
- ^ Brown, H. C.; Chloupek, F. J.; Rei, M. H. Comparison of the Rates of Solvolysis of Representative Norbornyl and Cyclopentyl Derivatives. A Critical Examination of Rates as a Basis for the Postulated Nonclassical Structure of Norbornyl Cations. Journal of the American Chemical Society. 1964, 86 (6): 1247. doi:10.1021/ja01060a059.
- ^ Brown, H. C.; Chloupek, F. J.; Rei, M. H. Rates of Solvolysis of the p-Nitrobenzoates of exo-endo' Tertiary Norborneols. A Critical Examination of the exo-endo Rate Ratio as a Basis for the Postulated Nonclassical Structure of the Norbornyl Cation. Journal of the American Chemical Society. 1964, 86 (6): 1248. doi:10.1021/ja01060a060.
- ^ Saunders, M.; Telkowski, L.; Kates, M. R. Isotopic perturbation of degeneracy. Carbon-13 nuclear magnetic resonance spectra of dimethylcyclopentyl and dimethylnorbornyl cations. Journal of the American Chemical Society. 1977, 99 (24): 8070. doi:10.1021/ja00466a060.
- ^ Saunders, M.; Kates, M. R. Isotopic perturbation of resonance. Carbon-13 nuclear magnetic resonance spectra of deuterated cyclohexenyl and cyclopentenyl cations. Journal of the American Chemical Society. 1977, 99 (24): 8071. doi:10.1021/ja00466a061.
- ^ Saunders, M.; Kates, M. R. Deuterium isotope effect on the carbon-13 NMR spectrum of the bicyclo[2.2.1]heptyl cation. Nonclassical norbornyl cation. Journal of the American Chemical Society. 1980, 102 (22): 6867. doi:10.1021/ja00542a044.
