逆轉錄酶
逆轉錄酶(全稱:依賴於RNA的DNA聚合酶[2])是一類存在於部分RNA病毒中具有逆轉錄活性、能以單鏈RNA為模板合成DNA的酶。由逆轉錄酶催化逆轉錄合成的DNA稱為互補DNA(cDNA)。
通常情況下,細胞內的轉錄是以DNA為模板合成RNA的,所得RNA為信使RNA(mRNA)供蛋白質合成作模板用。而在部分RNA病毒中,要實現自身的擴增,必須具有DNA,因此先由RNA逆轉錄合成cDNA再由cDNA轉錄出RNA。
逆轉錄酶可用於逆轉錄聚合酶連鎖反應,將RNA轉變爲DNA後擴增,以獲得某生物體表現RNA的序列。
這些活化因子會將逆轉錄病毒裏的單股RNA轉化成雙股cDNA並且將之插入宿主細胞的基因裏,在一段時間內繁殖。相同的反應被廣泛的應用在實驗室中將RNA轉換成DNA如分子克隆,RNA測序,聚合酶連鎖反應(PCR),或是DNA微陣列。 良好的逆轉錄酶研究物質包含:
發現
[編輯]逆轉錄酶是在美國威斯康星大學麥迪遜分校中的勞氏肉瘤病毒由霍華德·馬丁·特明發現的,[3]並且1970在麻省理工學院由戴維·巴爾的摩獨立從兩種RNA腫瘤病毒:R-MLV以及再一次勞氏肉瘤病毒中分離出來。[4]由於這些成就,兩人在1975年共同獲得了諾貝爾生理學或醫學獎(和羅納托·杜爾貝科)
逆轉錄這種想法因為違背了分子生物學中心法則,即DNA轉錄成RNA再轉譯成蛋白質的過程,因此非常不受到歡迎。然而,在1970時,當科學家霍華德·馬丁·特明和戴維·巴爾的摩兩人各自都從酶中發現逆轉錄的反應,將此命名為逆轉錄酶,此種逆轉錄的機制才被當時的主流接受。[5]
病毒的功能
[編輯]逆轉錄酶在逆轉錄病毒裏是用來在複製以及編碼的反應過程中。逆轉錄RNA病毒像是逆轉錄病毒,利用該酵素將他們的RNA基因組轉換成DNA,再將該DNA送至宿主細胞中,並且和宿主細胞的基因組一起進行複製。逆轉錄DNA病毒,像是嗜肝DNA病毒,可以在組裝時,將RNA當作模板製造出DNA。HIV藉由此酵素感染人類。若是沒有逆轉錄酶,這些病毒的基因組就不能和宿主細胞結合,進而導致複製失敗。
逆轉錄的過程
[編輯]逆轉錄酶從RNA模板中製造出單股DNA。在缺乏DNA-dependent DNA聚合酶的病毒中,雙股DNA的製造可以經由宿主編碼DNA聚合酶δ完成,過程中可能會將病毒的DNA-RNA引子誤認並且藉由和引子去除類似的機制合成出雙股DNA,而在新的合成的DNA即取代了舊有的RNA模板。逆轉錄的過程的錯誤率很高,因此在整個步驟中突變有很大的機會會發生。這種突變的現象可能會形成病毒的抗藥性。
逆轉錄病毒的逆轉錄
[編輯]
逆轉錄病毒,或稱VIssRNA-RT病毒,是用DNA當作中間產物的RNA逆轉錄病毒。他們的基因組通常由兩個正感知且有5』端帽和3』端聚線苷酸尾的單股RNA。逆轉錄酶如人類免疫缺乏病毒(HIV)和人類T淋巴細胞病毒HTLV。在細胞質中製造雙股DNA的過程有以下步驟[6]
- 由特殊細胞的tRNA當作引子,並且和互補的病毒基因組進行雜交,稱為引子黏接位或PBS。
- 互補DNA接下來和病毒RNA的U5(非編碼區)和R區(在RNA的兩邊末端的重複區域)結合。
- 在逆轉錄酶上的核糖核酸酶H會將用來移除U5和R區的5』端的RNA降解。
- 引子接下來會跳到病毒基因組中的3』端並且和新製造的一股DNA在RNA上雜交組合成互補的R區。
- 第一股互補DNA(cDNA)會被延展並且病毒的主要RNA會被RNAse H降解。
- 一旦一股完成了,第二股就會從病毒的RNA的一開始進行合成
- 接下來另外一個引子就會跳到第二股的PBS處,與第一股互補的PBS進行雜交
- 雙股會被延展並藉由整合酶被併入宿主細胞
製造雙股DNA也牽涉到股的轉移,即從一開始的RNA dependent DNA合成出來較短的DNA轉移至其他基因組模板中的受體,而此受體接下來會藉由逆轉錄酶進行DNA-dependent DNA的活化。[7]
逆轉錄病毒的RNA在5』端和3』端被重新排列。引子黏接在RNA病毒的位置的區域稱為引子結合位點(PBS)。PBS區的5』端稱為U5,而PBS的3』端稱為領先區。tRNA的引子在14和22區的核苷酸被解開且和病毒的RNA與PBS形成鹼基對。事實上PBS在病毒的RNA的5』端上是不正常的,因為逆轉錄酶是從3』端合成出DNA,方向是5』到3』(相對於RNA模板)。因此引子和逆轉錄酶必須位在病毒的RNA的3』端。為了成功的將之重新定位,需要許多的步驟以及酵素,包含DNA聚合酶,RNAse H以及已解開的的聚合苷酸來參與反應。[8]
HIV的逆轉錄酶也有核糖核酸酶用來活化,目的是將在合成cDNA的過程中將病毒的RNA降解,如同DNA依賴的DNA聚合酶將cDNA股合成為無意義的DNA來組成病毒的雙股DNA中間產物(vDNA)。[9]
在真核生物
[編輯]自行複製真核細胞的延長基因組稱為逆轉錄轉座子,藉由逆轉錄酶去移除RNA的其中一個位置。他們在植物和動物中的基因組中大量發現。端粒酶是另外一種逆轉錄酶,在許多真核生物,像是有自己的RNA模板的人類中發現,這些RNA會被用來當作DNA複製的模板。 [10]
在原核生物
[編輯]逆轉錄酶亦從細菌的Retron msr RNAs,一種特殊的片段,由逆轉錄酶編碼,且拿來合成msDNA。合成DNA時需要引子。在細菌裏,引子的合成是在複製的過程中製造。 [11]
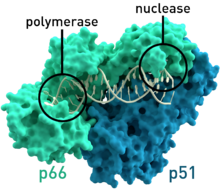
構造
[編輯]逆轉錄酶包含RNA-dependent DNA聚合酶和DNA-polymerase DNA聚合酶,兩者一起用來表現轉錄的過程。在一開始轉錄因子中,逆轉錄病毒的逆轉錄酶有RNase H家族的重要區域。
複製保真度
[編輯]逆轉錄病毒的生活史中有三種不同的複製系統。第一種,逆轉錄酶從病毒的RNA合成出病毒的DNA,進而製造出新的互補DNA。第二種複製方式則是在宿主細胞的DNA聚合酶開始複製黏合上去的病毒DNA後,RNA聚合酶II就會將原病毒的DNA轉錄成之後和病毒顆粒包裝在一起的RNA。因此,突變可以在這些步驟中發生。 [12]
逆轉錄酶在將RNA變成DNA時有很高的錯誤率,不像其他的DNA聚合酶,他沒有校正的功能。這種較高的錯誤率相對於有校正的複製過程,可以促進突變的累積。一般市面上由Promega購買到的逆轉錄酶,說在AMV中有每17000個鹼基就有一個是突變的,而在M-MLV中每30000個鹼基就有一個是突變的。[13]
除了創造單核甘酸的基因多樣性外,逆轉錄酶也在一些步驟初級產物融合或外顯子重組並且做出人造的反義RNA轉錄產物。[14][15]這種「模板的切換」被推測,這種可以完整的在體內中進行反應的逆轉錄酶,通常有着可以找出在模式生物中數千個未註明的轉錄產物。[16]
應用
[編輯]
抗病毒藥物
[編輯]更多有關抗病毒藥物的細節,請參照逆轉錄酶抑制劑。當HIV利用逆轉錄酶將基因的物質複製並且產生出新的病毒(部分逆轉錄病毒的增殖圈),特殊的藥物被設計成用來阻斷逆轉錄酶反應的過程,並且抑制逆轉錄病毒的生長,這些藥物被稱作逆轉錄酶抑制劑且包含核甘以及核甘酸相似的物質,齊多夫定(多夫),拉米夫定(博路定),和非核甘抑制劑奈韋拉平(維樂命)。
分子生物學
[編輯]更多有關分子生物學的細節,請參照逆轉錄聚合酶連鎖反應。逆轉錄酶常用來應用在聚合酶連鎖反應這種研究方式中,以RNA為主的技術稱作逆轉錄聚合酶連鎖反應(RT-PCR)。典型的PCR技術只能用來用在DNA上,但是有着逆轉錄酶的幫助下,RNA亦可以被逆轉錄成DNA,因此使PCR可以分析RNA分子。逆轉錄酶也同時被應用在從MRNA製作cDNA基因庫,市面上買的到的逆轉錄酶通常在分子生物界裏都是被改良過的。其他酵素可被科學家用來進行複製或者定義RNA。
逆轉錄酶也被拿來用在胰島素的製作。藉由將真核細胞的胰島素的mRNA和逆轉錄酶注入細菌中,mRNA就可以插入原生生物的基因組裏,大量的胰島素就可被製造,可用來取代從豬隻的胰島萃取等的傳統方式 直接將真核細胞的DNA注入到細菌的染色質裏。在真核細胞mRNA的生產過程中,去除內含子,並且提供一個適當的模板。逆轉錄酶將RNA重新編成DNA,因此可以拿來和基因組黏合。
參見
[編輯]參考文獻
[編輯]- ^ PDB 3KLF; Tu X, Das K, Han Q, Bauman JD, Clark AD Jr, Hou X, Frenkel YV, Gaffney BL, Jones RA, Boyer PL, Hughes SH, Sarafianos SG, Arnold E. Structural basis of HIV-1 resistance to AZT by excision.. Nat. Struct. Mol. Biol. September 2010, 17 (10): 1202–9. PMC 2987654
 . PMID 20852643. doi:10.1038/nsmb.1908.
. PMID 20852643. doi:10.1038/nsmb.1908.
- ^ Setubal, João Carlos. Introduction to computational molecular biology. 分子生物学导论. World Pub. Corperation. 2003 [2020-07-17]. ISBN 7-5062-6574-5. OCLC 659952104. (原始內容存檔於2020-07-20).
- ^ Temin HM, Mizutani S. RNA-dependent DNA polymerase in virions of Rous sarcoma virus. Nature. June 1970, 226 (5252): 1211–3. PMID 4316301. doi:10.1038/2261211a0.
- ^ Baltimore D. RNA-dependent DNA polymerase in virions of RNA tumour viruses. Nature. June 1970, 226 (5252): 1209–11. PMID 4316300. doi:10.1038/2261209a0.
- ^ Central dogma reversed. Nature. June 1970, 226 (5252): 1198–9. PMID 5422595. doi:10.1038/2261198a0.
- ^ Bio-Medicine.org - Retrovirus (頁面存檔備份,存於互聯網檔案館) Retrieved on 17 Feb, 2009
- ^ Telesnitsky A, Goff SP. Strong-stop strand transfer during reverse transcription. Skalka, M. A., Goff, S.P (編). Reverse transcriptase 1st. New York: Cold Spring Harbor. 1993: 49. ISBN 0-87969-382-7.
- ^ Bernstein A, Weiss R, Tooze J. RNA tumor viruses. Molecular Biology of Tumor Viruses 2nd. Cold Spring Harbor, N.Y: Cold Spring Harbor Laboratory. 1985.
- ^ Doc Kaiser's Microbiology Home Page > IV. VIRUSES > F. ANIMAL VIRUS LIFE CYCLES > 3. The Life Cycle of HIV 互聯網檔案館的存檔,存檔日期2010-07-26. Community College of Baltimore County. Updated: Jan., 2008
- ^ Krieger M, Scott MP, Matsudaira PT, Lodish HF, Darnell JE, Zipursky L, Kaiser C, Berk A. Molecular cell biology. New York: W.H. Freeman and CO. 2004. ISBN 0-7167-4366-3.
- ^ Hurwitz J, Leis JP. RNA-dependent DNA polymerase activity of RNA tumor viruses. I. Directing influence of DNA in the reaction. J. Virol. January 1972, 9 (1): 116–29. PMC 356270
 . PMID 4333538.
. PMID 4333538.
- ^ Bbenek K, Kunkel AT. The fidelity of retroviral reverse transcriptases. Skalka, M. A., Goff, P. S. (編). Reverse transcriptase. New York: Cold Spring Harbor Laboratory Press. 1993: 85. ISBN 0-87969-382-7.
- ^ Promega kit instruction manual (1999) 互聯網檔案館的存檔,存檔日期2006-11-21.
- ^ Houseley J, Tollervey D. Apparent non-canonical trans-splicing is generated by reverse transcriptase in vitro. PLoS ONE. 2010, 5 (8): e12271. PMC 2923612
 . PMID 20805885. doi:10.1371/journal.pone.0012271.
. PMID 20805885. doi:10.1371/journal.pone.0012271.
- ^ Zeng XC, Wang SX. Evidence that BmTXK beta-BmKCT cDNA from Chinese scorpion Buthus martensii Karsch is an artifact generated in the reverse transcription process. FEBS Lett. June 2002, 520 (1-3): 183–4; author reply 185. PMID 12044895. doi:10.1016/S0014-5793(02)02812-0.
- ^ van Bakel H, Nislow C, Blencowe BJ, Hughes TR. Response to "The Reality of Pervasive Transcription". PLoS Biology. 2011, 9 (7): e1001102. doi:10.1371/journal.pbio.1001102.
外部連結
[編輯]- 醫學主題詞表(MeSH):RNA+轉錄酶
- 逆轉錄酶的動畫以及三種逆轉錄酶的抑制劑
- 分子月 (頁面存檔備份,存於互聯網檔案館)(9月2002)在RCSB PDB
- 愛滋病病毒複製的3D醫學動畫. (11月2008).由Boehringer Ingelheim製作. (頁面存檔備份,存於互聯網檔案館)
- Goodsell DS. 分子月:反轉錄酶 (Sep 2002). 結構生物資訊學(RCSB)的合作研究實驗室。蛋白質數據銀行(PDB). [2013-01-13]. (原始內容存檔於2015-10-19).