逆转录酶
逆转录酶(全称:依赖于RNA的DNA聚合酶[2])是一类存在于部分RNA病毒中具有逆转录活性、能以单链RNA为模板合成DNA的酶。由逆转录酶催化逆转录合成的DNA称为互补DNA(cDNA)。
通常情况下,细胞内的转录是以DNA为模板合成RNA的,所得RNA为信使RNA(mRNA)供蛋白质合成作模板用。而在部分RNA病毒中,要实现自身的扩增,必须具有DNA,因此先由RNA逆转录合成cDNA再由cDNA转录出RNA。
逆转录酶可用于逆转录聚合酶链式反应,将RNA转变为DNA后扩增,以获得某生物体表现RNA的序列。
这些活化因子会将反转录病毒里的单股RNA转化成双股cDNA并且将之插入宿主细胞的基因里,在一段时间内繁殖。相同的反应被广泛的应用在实验室中将RNA转换成DNA如分子克隆,RNA测序,聚合酶链反应(PCR),或是DNA微阵列。 良好的反转录酶研究物质包含:
发现
[编辑]反转录酶是在美国威斯康星大学麦迪逊分校中的劳氏肉瘤病毒由霍华德·马丁·特明发现的,[3]并且1970在麻省理工学院由戴维·巴尔的摩独立从两种RNA肿瘤病毒:R-MLV以及再一次劳氏肉瘤病毒中分离出来。[4]由于这些成就,两人在1975年共同获得了诺贝尔生理学或医学奖(和罗纳托·杜尔贝科)
反转录这种想法因为违背了分子生物学中心法则,即DNA转录成RNA再转译成蛋白质的过程,因此非常不受到欢迎。然而,在1970时,当科学家霍华德·马丁·特明和戴维·巴尔的摩两人各自都从酶中发现反转录的反应,将此命名为反转录酶,此种反转录的机制才被当时的主流接受。[5]
病毒的功能
[编辑]反转录酶在反转录病毒里是用来在复制以及编码的反应过程中。反转录RNA病毒像是反转录病毒,利用该酵素将他们的RNA基因组转换成DNA,再将该DNA送至宿主细胞中,并且和宿主细胞的基因组一起进行复制。反转录DNA病毒,像是嗜肝DNA病毒,可以在组装时,将RNA当作模板制造出DNA。HIV借由此酵素感染人类。若是没有反转录酶,这些病毒的基因组就不能和宿主细胞结合,进而导致复制失败。
反转录的过程
[编辑]反转录酶从RNA模板中制造出单股DNA。在缺乏DNA-dependent DNA聚合酶的病毒中,双股DNA的制造可以经由宿主编码DNA聚合酶δ完成,过程中可能会将病毒的DNA-RNA引子误认并且借由和引子去除类似的机制合成出双股DNA,而在新的合成的DNA即取代了旧有的RNA模板。反转录的过程的错误率很高,因此在整个步骤中突变有很大的机会会发生。这种突变的现象可能会形成病毒的抗药性。
反转录病毒的反转录
[编辑]
反转录病毒,或称VIssRNA-RT病毒,是用DNA当作中间产物的RNA反转录病毒。他们的基因组通常由两个正感知且有5’端帽和3’端聚线苷酸尾的单股RNA。反转录酶如人类免疫缺乏病毒(HIV)和人类T淋巴细胞病毒HTLV。在细胞质中制造双股DNA的过程有以下步骤[6]
- 由特殊细胞的tRNA当作引子,并且和互补的病毒基因组进行杂交,称为引子黏接位或PBS。
- 互补DNA接下来和病毒RNA的U5(非编码区)和R区(在RNA的两边末端的重复区域)结合。
- 在反转录酶上的核糖核酸酶H会将用来移除U5和R区的5’端的RNA降解。
- 引子接下来会跳到病毒基因组中的3’端并且和新制造的一股DNA在RNA上杂交组合成互补的R区。
- 第一股互补DNA(cDNA)会被延展并且病毒的主要RNA会被RNAse H降解。
- 一旦一股完成了,第二股就会从病毒的RNA的一开始进行合成
- 接下来另外一个引子就会跳到第二股的PBS处,与第一股互补的PBS进行杂交
- 双股会被延展并借由整合酶被并入宿主细胞
制造双股DNA也牵涉到股的转移,即从一开始的RNA dependent DNA合成出来较短的DNA转移至其他基因组模板中的受体,而此受体接下来会借由反转录酶进行DNA-dependent DNA的活化。[7]
反转录病毒的RNA在5’端和3’端被重新排列。引子黏接在RNA病毒的位置的区域称为引物结合位点(PBS)。PBS区的5’端称为U5,而PBS的3’端称为领先区。tRNA的引子在14和22区的核苷酸被解开且和病毒的RNA与PBS形成碱基对。事实上PBS在病毒的RNA的5’端上是不正常的,因为反转录酶是从3’端合成出DNA,方向是5’到3’(相对于RNA模板)。因此引子和反转录酶必须位在病毒的RNA的3’端。为了成功的将之重新定位,需要许多的步骤以及酵素,包含DNA聚合酶,RNAse H以及已解开的的聚合苷酸来参与反应。[8]
HIV的反转录酶也有核糖核酸酶用来活化,目的是将在合成cDNA的过程中将病毒的RNA降解,如同DNA依赖的DNA聚合酶将cDNA股合成为无意义的DNA来组成病毒的双股DNA中间产物(vDNA)。[9]
在真核生物
[编辑]自行复制真核细胞的延长基因组称为反转录转座子,借由反转录酶去移除RNA的其中一个位置。他们在植物和动物中的基因组中大量发现。端粒酶是另外一种反转录酶,在许多真核生物,像是有自己的RNA模板的人类中发现,这些RNA会被用来当作DNA复制的模板。 [10]
在原核生物
[编辑]反转录酶亦从细菌的Retron msr RNAs,一种特殊的片段,由反转录酶编码,且拿来合成msDNA。合成DNA时需要引子。在细菌里,引子的合成是在复制的过程中制造。 [11]
构造
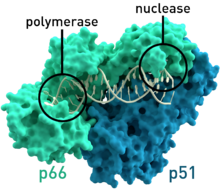
[编辑]反转录酶包含RNA-dependent DNA聚合酶和DNA-polymerase DNA聚合酶,两者一起用来表现转录的过程。在一开始转录因子中,反转录病毒的反转录酶有RNase H家族的重要区域。
复制保真度
[编辑]反转录病毒的生活史中有三种不同的复制系统。第一种,反转录酶从病毒的RNA合成出病毒的DNA,进而制造出新的互补DNA。第二种复制方式则是在宿主细胞的DNA聚合酶开始复制黏合上去的病毒DNA后,RNA聚合酶II就会将原病毒的DNA转录成之后和病毒颗粒包装在一起的RNA。因此,突变可以在这些步骤中发生。 [12]
反转录酶在将RNA变成DNA时有很高的错误率,不像其他的DNA聚合酶,他没有校正的功能。这种较高的错误率相对于有校正的复制过程,可以促进突变的累积。一般市面上由Promega购买到的反转录酶,说在AMV中有每17000个碱基就有一个是突变的,而在M-MLV中每30000个碱基就有一个是突变的。[13]
除了创造单核甘酸的基因多样性外,反转录酶也在一些步骤初级产物融合或外显子重组并且做出人造的反义RNA转录产物。[14][15]这种“模板的切换”被推测,这种可以完整的在体内中进行反应的反转录酶,通常有著可以找出在模式生物中数千个未注明的转录产物。[16]
应用
[编辑]
抗病毒药物
[编辑]更多有关抗病毒药物的细节,请参照反转录酶抑制剂。当HIV利用反转录酶将基因的物质复制并且产生出新的病毒(部分反转录病毒的增殖圈),特殊的药物被设计成用来阻断反转录酶反应的过程,并且抑制反转录病毒的生长,这些药物被称作反转录酶抑制剂且包含核甘以及核甘酸相似的物质,齐多夫定(多夫),拉米夫定(博路定),和非核甘抑制剂奈韦拉平(维乐命)。
分子生物学
[编辑]更多有关分子生物学的细节,请参照反转录聚合酶链反应。反转录酶常用来应用在聚合酶链反应这种研究方式中,以RNA为主的技术称作反转录聚合酶链反应(RT-PCR)。典型的PCR技术只能用来用在DNA上,但是有著反转录酶的帮助下,RNA亦可以被反转录成DNA,因此使PCR可以分析RNA分子。反转录酶也同时被应用在从MRNA制作cDNA基因库,市面上买的到的反转录酶通常在分子生物界里都是被改良过的。其他酵素可被科学家用来进行复制或者定义RNA。
反转录酶也被拿来用在胰岛素的制作。借由将真核细胞的胰岛素的mRNA和反转录酶注入细菌中,mRNA就可以插入原生生物的基因组里,大量的胰岛素就可被制造,可用来取代从猪只的胰岛萃取等的传统方式 直接将真核细胞的DNA注入到细菌的染色质里。在真核细胞mRNA的生产过程中,去除内含子,并且提供一个适当的模板。反转录酶将RNA重新编成DNA,因此可以拿来和基因组黏合。
参见
[编辑]参考文献
[编辑]- ^ PDB 3KLF; Tu X, Das K, Han Q, Bauman JD, Clark AD Jr, Hou X, Frenkel YV, Gaffney BL, Jones RA, Boyer PL, Hughes SH, Sarafianos SG, Arnold E. Structural basis of HIV-1 resistance to AZT by excision.. Nat. Struct. Mol. Biol. September 2010, 17 (10): 1202–9. PMC 2987654
 . PMID 20852643. doi:10.1038/nsmb.1908.
. PMID 20852643. doi:10.1038/nsmb.1908.
- ^ Setubal, João Carlos. Introduction to computational molecular biology. 分子生物学导论. World Pub. Corperation. 2003 [2020-07-17]. ISBN 7-5062-6574-5. OCLC 659952104. (原始内容存档于2020-07-20).
- ^ Temin HM, Mizutani S. RNA-dependent DNA polymerase in virions of Rous sarcoma virus. Nature. June 1970, 226 (5252): 1211–3. PMID 4316301. doi:10.1038/2261211a0.
- ^ Baltimore D. RNA-dependent DNA polymerase in virions of RNA tumour viruses. Nature. June 1970, 226 (5252): 1209–11. PMID 4316300. doi:10.1038/2261209a0.
- ^ Central dogma reversed. Nature. June 1970, 226 (5252): 1198–9. PMID 5422595. doi:10.1038/2261198a0.
- ^ Bio-Medicine.org - Retrovirus (页面存档备份,存于互联网档案馆) Retrieved on 17 Feb, 2009
- ^ Telesnitsky A, Goff SP. Strong-stop strand transfer during reverse transcription. Skalka, M. A., Goff, S.P (编). Reverse transcriptase 1st. New York: Cold Spring Harbor. 1993: 49. ISBN 0-87969-382-7.
- ^ Bernstein A, Weiss R, Tooze J. RNA tumor viruses. Molecular Biology of Tumor Viruses 2nd. Cold Spring Harbor, N.Y: Cold Spring Harbor Laboratory. 1985.
- ^ Doc Kaiser's Microbiology Home Page > IV. VIRUSES > F. ANIMAL VIRUS LIFE CYCLES > 3. The Life Cycle of HIV 互联网档案馆的存档,存档日期2010-07-26. Community College of Baltimore County. Updated: Jan., 2008
- ^ Krieger M, Scott MP, Matsudaira PT, Lodish HF, Darnell JE, Zipursky L, Kaiser C, Berk A. Molecular cell biology. New York: W.H. Freeman and CO. 2004. ISBN 0-7167-4366-3.
- ^ Hurwitz J, Leis JP. RNA-dependent DNA polymerase activity of RNA tumor viruses. I. Directing influence of DNA in the reaction. J. Virol. January 1972, 9 (1): 116–29. PMC 356270
 . PMID 4333538.
. PMID 4333538.
- ^ Bbenek K, Kunkel AT. The fidelity of retroviral reverse transcriptases. Skalka, M. A., Goff, P. S. (编). Reverse transcriptase. New York: Cold Spring Harbor Laboratory Press. 1993: 85. ISBN 0-87969-382-7.
- ^ Promega kit instruction manual (1999) 互联网档案馆的存档,存档日期2006-11-21.
- ^ Houseley J, Tollervey D. Apparent non-canonical trans-splicing is generated by reverse transcriptase in vitro. PLoS ONE. 2010, 5 (8): e12271. PMC 2923612
 . PMID 20805885. doi:10.1371/journal.pone.0012271.
. PMID 20805885. doi:10.1371/journal.pone.0012271.
- ^ Zeng XC, Wang SX. Evidence that BmTXK beta-BmKCT cDNA from Chinese scorpion Buthus martensii Karsch is an artifact generated in the reverse transcription process. FEBS Lett. June 2002, 520 (1-3): 183–4; author reply 185. PMID 12044895. doi:10.1016/S0014-5793(02)02812-0.
- ^ van Bakel H, Nislow C, Blencowe BJ, Hughes TR. Response to "The Reality of Pervasive Transcription". PLoS Biology. 2011, 9 (7): e1001102. doi:10.1371/journal.pbio.1001102.
外部链接
[编辑]- 医学主题词表(MeSH):RNA+转录酶
- 反转录酶的动画以及三种反转录酶的抑制剂
- 分子月 (页面存档备份,存于互联网档案馆)(9月2002)在RCSB PDB
- 爱滋病病毒复制的3D医学动画. (11月2008).由Boehringer Ingelheim制作. (页面存档备份,存于互联网档案馆)
- Goodsell DS. 分子月:反轉錄酶 (Sep 2002). 结构生物信息学(RCSB)的合作研究实验室。蛋白质数据银行(PDB). [2013-01-13]. (原始内容存档于2015-10-19).