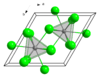
氯化鑭
外觀
| 氯化鑭 | |||
|---|---|---|---|
| |||

| |||
| 別名 | 三氯化鑭 | ||
| 識別 | |||
| CAS號 | 10099-58-8 10025-84-0(七水) 17272-45-6(六水) 20211-76-1(水合) | ||
| PubChem | 64735 | ||
| ChemSpider | 58275 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | ICAKDTKJOYSXGC-DFZHHIFOAJ | ||
| 性質 | |||
| 化學式 | LaCl3 | ||
| 摩爾質量 | 245.26 g/mol (無水) 371.37 g/mol (七水) g·mol⁻¹ | ||
| 外觀 | 白色無味潮解粉末 | ||
| 密度 | 3.84 g/cm3[1] | ||
| 熔點 | 858 °C (無水)[1] | ||
| 沸點 | 1000 °C (無水) | ||
| 溶解性(水) | 957 g·L−1(25 °C)[1] | ||
| 溶解性 | 七水物可溶於乙醇 | ||
| 結構 | |||
| 晶體結構 | 六方晶系三氯化鈾型結構,hP8 | ||
| 空間群 | P63/m, No. 176 | ||
| 配位幾何 | 三帽三角稜柱體 (九配位) | ||
| 危險性 | |||
| 歐盟編號 | 未列出 | ||
| 相關物質 | |||
| 其他陰離子 | 氟化鑭 溴化鑭 碘化鑭 | ||
| 其他陽離子 | 氯化鈧 氯化釔 氯化錒 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
氯化鑭是一種無機化合物,化學式為LaCl3,它存在無水物和多種水合物,為白色粉末或無色晶體。
製備
[編輯]以從稀土礦物中得到的稀土氯化物或其硫酸銨復鹽為原料,用氫氧化鈉處理,並將其中的鈰用過氧化氫氧化為四價,用稀鹽酸浸出,得到富鑭母液和富鈰渣。富鑭母液再經萃取分離除去鈰後,經結晶得到氯化鑭的水合物。[2]
- La(OH)3 + 3 HCl → LaCl3 + 3 H2O
將得到的氯化鑭水合物在乾燥的氯化氫中加熱,可以得到無水物。[3]
它的無水物也可由氯化銨法製得,第一步反應形成五氯合鑭酸銨,第二步將生成的銨鹽在真空中於350~400 °C熱分解:[4][5][6]
- La2O3 + 10 NH4Cl → 2 (NH4)2LaCl5 + 6 H2O + 6 NH3
- (NH4)2LaCl5 → LaCl3 + 2 HCl + 2 NH3
- La2O3 + 3 CCl4 → 2 LaCl3 + 3 COCl2
反應
[編輯]氯化鑭和氟硅酸鈉在水溶液中反應,生成氟化鑭。[8]它和鉭酸鑭反應在高溫反應,可以得到La2TaO4Cl3。[9]
應用
[編輯]氯化鑭可以用作催化劑,如它可以催化鄰苯二胺和苯甲醛的反應,得到2-苯基苯並咪唑;[10]它也可以催化甲烷的氯化反應。[11]
參考資料
[編輯]- ^ 1.0 1.1 1.2 Lide, David R. (編), CRC Handbook of Chemistry and Physics 87th, Boca Raton, FL: CRC Press, 2006, ISBN 0-8493-0487-3
- ^ 廖春生, 王嵩齡, 吳聲. 氟碳鈰礦製備富鑭氯化稀土的方法 (頁面存檔備份,存於網際網路檔案館). 2010. CN101914679 B
- ^ Observations on the Rare Earths. XXIX. The Preparation and Properties of Some Anhydrous Rare Earth Chlorides. J. Am. Chem. Soc. 1928, 50 (4): 959–967 [2023-09-01]. doi:10.1021/ja01391a005. (原始內容存檔於2023-09-01).
- ^ Brauer, G. (編). Handbook of Preparative Inorganic Chemistry 2nd. New York: Academic Press. 1963.
- ^ Meyer, G. The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides-The Example of YCl3. Inorganic Syntheses 25. 1989: 146–150. ISBN 978-0-470-13256-2. doi:10.1002/9780470132562.ch35.
- ^ Edelmann, F. T.; Poremba, P. Herrmann, W. A. , 編. Synthetic Methods of Organometallic and Inorganic Chemistry VI. Stuttgart: Georg Thieme Verlag. 1997. ISBN 978-3-13-103021-4.
- ^ Gabbe, D. R., Folweiler, R. C., & Pink, F. X. Synthesis, Ultrapurification and Analysis of LaF3 for Fluoride Optical Fibers (88). MRS Proceedings. 1986 [2023-09-01]. doi:10.1557/proc-88-119. (原始內容存檔於2023-09-01).
- ^ Bleshinskii, S. V.; Kharakoz, A. E.; Lukin, I. N.; Chalova, E. P. Reaction of hexafluorosilicates with salts of rare earth elements (俄文). Issled. Khim. Redk. Soputstv. Elem. 1966, (21-9).. CODEN 16CJAW
- ^ Schaffrath, U.; Gruehn, R. La2TaO4Cl3- a new oxochlorotantalate with TaO5 building units (德文). Zeitschrift fuer Naturforschung, B: Chemical Sciences: 412–418. ISSN 0932-0776.
- ^ Venkateswarlu, Y., Kumar, S.R. & Leelavathi, P. Facile and efficient one-pot synthesis of benzimidazoles using lanthanum chloride. Organic and Medicinal Chemistry Letters. 2013, 7 (3) [2023-09-01]. doi:10.1186/2191-2858-3-7. (原始內容存檔於2023-09-01).
- ^ Elvira Peringer, Chirag Tejuja, Michael Salzinger, Angeliki A. Lemonidou, Johannes A. Lercher. On the synthesis of LaCl3 catalysts for oxidative chlorination of methane. Applied Catalysis A: General. 2008, 350 (2): 178–185. doi:10.1016/j.apcata.2008.08.009.
- ^ C Rosales, E J Brown. Calcium channel blockers nifedipine and diltiazem inhibit Ca2+ release from intracellular stores in neutrophils. Journal of Biological Chemistry. 1992, 267 (3): 1443–1448 [2023-09-01]. doi:10.1016/S0021-9258(18)45965-0. (原始內容存檔於2023-09-01).