反苯环丙胺
 | |
 | |
| 临床资料 | |
|---|---|
| 怀孕分级 |
|
| 给药途径 | 口服 |
| ATC码 | |
| 药物动力学数据 | |
| 生物利用度 | 50%[1] |
| 药物代谢 | 肝脏(被CYP2A6、CYP2C19、CYP2D6、MAOA和MAOB催化) |
| 生物半衰期 | 2.5小时[1] |
| 排泄途径 | 尿液、粪便[1] |
| 识别信息 | |
| |
| CAS号 | 155-09-9 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| ECHA InfoCard | 100.005.312 |
| 化学信息 | |
| 化学式 | C9H11N |
| 摩尔质量 | 133.19 g/mol |
| 3D模型(JSmol) | |
| |
反苯环丙胺(Tranylcypromine,原商品名Parnate)是一种单胺氧化酶(MAO)的非选择性和不可逆性抑制剂(MAOI),[2]其属于苯乙胺和安非他命类。临床上用于治疗重度抑郁症、焦虑症和强迫症。
医疗用途
[编辑]反苯环丙胺用于治疗重性抑郁障碍,包括非典型抑郁,尤其是在共病焦虑时,反苯环丙胺一般作为二线选择。[3]它也可用于对再摄取抑制剂抗抑郁药(例如SSRI、SNRI、TCA、NDRI)没有反应的抑郁症。[4]
禁忌症
[编辑]- 卟啉症
- 心血管疾病或脑血管疾病
- 嗜铬细胞瘤
- 含有较多酪胺的食物。酪胺通过MAO代谢,摄取大量的酪胺会使去甲肾上腺素(norepinephrine,NE)大量释放,使血压迅速增高而引起高血压危象。
- 同时使用5-羟色胺(serotonin, 5-HT)增强药物,包括SSRIs,5-羟色胺能TCAs,右美沙芬和哌替啶可能会引发5-羟色胺综合征。
- 同时使用单胺释放剂,例如芬氟拉明、苯丙胺和伪麻黄碱可能通过5-羟色胺综合征或高血压危象引起毒性。
- 在不使用卡比多巴的情况下使用L-多巴可能引起高血压危象。
饮食限制
[编辑]酪胺是许多食品中常见的成分,其通过MAO-A快速代谢。不服用反苯环丙胺的个体可能在一餐中摄入超过2g酪胺而不引起血压升高,而服用反苯环丙胺的个体可能在仅摄入不到10mg酪胺的情况下出现血压急剧升高,引发高血压危象。[7][8]
含有酪胺的食物包括陈年奶酪、腌制肉类、豆腐和某些红葡萄酒。有些食物,例如酵母提取物,含有足够的酪胺,食用一份就可能致命。变质的食物也可能含有危险水平的酪胺。[5]然而,随着食品制作工艺和卫生监管的进步,今日的食物中罕见有高水平的酪胺。如今大部分奶酪,即使是“熟透了的”甚至也是安全的。除了对于少数高酪胺食物而言,现如今使用反苯环丙胺不必忌口。
不良反应
[编辑]非常常见(发生率>10%)的不良反应包括:
[编辑]- 继发于体位性低血压的眩晕(17%)
常见(1-10%发生率)不良反应包括:
[编辑]- 心动过速(5-10%)
- 轻躁狂(7%)
- 消瘦(2%)
- 慌乱(2%)
- 口干(2%)
- 性功能障碍(2%)
- 高血压(摄入后1~2小时)(2%)
- 皮疹(2%)
- 尿储留(2%)
其他(发生率未知)不良反应包括:
[编辑]- 食欲增加/减少
- 血液恶液质
- 胸痛
- 腹泻
- 浮肿
- 幻觉
- 反射亢进
- 失眠
- 黄疸
- 腿抽筋
- 肌痛
- 心悸
- 感觉寒冷
- 自杀意念
- 颤抖
值得注意的是,尚未发现性别与65岁之下的年龄相关的不良反应发生率的相关性。[9]
与肼类MAOI相比,反苯环丙胺与体重增加无关,并且具有较低的肝毒性风险。[4][9]通常建议在麻醉前停用MAOI,但这会增加抑郁复发的风险。在一项回顾性观察性队列研究中发现接受全麻的使用反苯环丙胺的患者术中低血压的发生率较低,与未使用MAOI治疗的患者的心动过缓、心动过速和高血压的发生率没有差异。[10]使用间接拟交感神经药物或影响5-羟色胺再摄取的药物,如哌替啶或右美沙芬,分别会导致高血压和5-羟色胺综合征的风险,建议使用替代药物。[11][12]其他的研究得到了同样的结论[9]鉴于反苯环丙胺是CYP2A6的高亲和力底物并且在治疗浓度下不抑制CYP酶,因此不太可能与麻醉剂发生药代动力学的相互作用。[2]
据报道,反苯环丙胺的滥用者会每天摄入120~600mg的反苯环丙胺。[5][9][13]据认为高剂量的反苯环丙胺会有更强的安非他命样效果。起效迅速和短暂的半衰期加剧了反苯环丙胺的滥用。[9]
据报道,有在使用反苯环丙胺治疗的过程中,或停药早期,存在自杀观念或自杀想法的病例。
反苯环丙胺过量的症状通常是其常见作用的更强烈表现。[5]
相互作用
[编辑]除了禁忌的联合用药,反苯环丙胺还能抑制CYP2A6,这可能会抑制这种酶的底物的代谢并增加其毒性,例如:[8]
去甲肾上腺素再摄取抑制剂(NRI)可以防止神经元对酪胺的摄取,并可降低其升高血压的作用。
药理学
[编辑]药效学
[编辑]反苯环丙胺作为MAO的非选择性和不可逆的抑制剂而发挥作用。[14]对于MAO的亚型,相对于对MAO-A而言,其对MAO-B略有偏好。[7]这导致单胺类如5-羟色胺、去甲肾上腺素和多巴胺的可用性增加,而且痕量胺例如色胺、章鱼胺和苯乙胺的可用性显著增加。[7][8]
在较高剂量下,它可以充当去甲肾上腺素再摄取抑制剂。[7]与苯丙胺相比,反苯环丙胺作为多巴胺释放剂的效力相对较低,对促进去甲肾上腺素和5-羟色胺释放的效力甚至更低。[7][8]
反苯环丙胺也被证明可以抑制组蛋白去甲基化酶BHC110/LSD1,反苯环丙胺组蛋白去甲基化酶抑制的IC50<2μm,因此它可发挥组蛋白去甲基化的小分子抑制剂的作用,有降低BHC110/LSD1靶基因转录活性的作用。[15]这种效应的临床相关性尚不清楚。
已发现反苯环丙胺以纳摩尔浓度抑制CYP46A1。这种效应的临床相关性尚不清楚。[16]
药代动力学
[编辑]反苯环丙胺在1~2小时内达到最大浓度(tmax),广泛在体内分布,主要在肝脏代谢,经尿液排泄,其中主要以代谢物的形式排泄,原形仅占2%。[7]剂量为20mg时,血药浓度最高可达50~200ng/ml。[7]虽然其半衰期仅约2小时,但由于它对MAO的不可逆的抑制,其药效学效应可以持续数天甚至数周。
反苯环丙胺的代谢产物包括4-羟基香叶基环丙胺、N-乙酰基香叶基环丙胺和N-乙酰基-4-羟基香叶基环丙胺,它们是比反苯环丙胺弱的MAOI。[7]安非他命曾被认为是反苯环丙胺的代谢产物,但尚未被证实[7][17][8]
反苯环丙胺在治疗浓度下抑制CYP2A6。[8]
合成
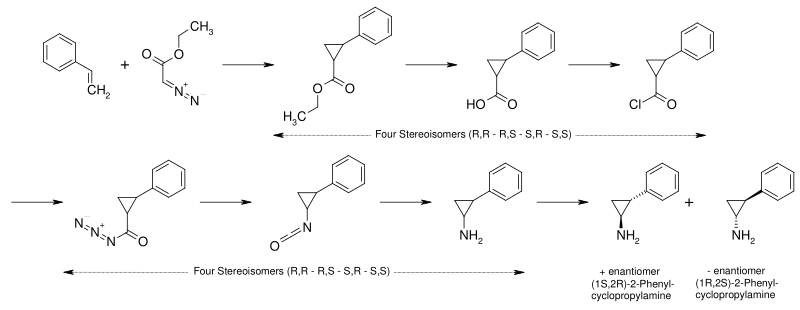
[编辑]反苯环丙胺是安非他命的环丙基类似物。它可以通过如下路线制取:[18][19]
- 苯乙烯与重氮乙酸乙酯反应生成2-苯基环丙烷甲酸乙酯。
- 2-苯基环丙烷甲酸乙酯在碱存在下水解生成2-苯基环丙烷甲酸。
- 2-苯基环丙烷甲酸与氯化亚砜反应生成2-苯基环丙烷甲酰氯。
- 2-苯基环丙烷甲酰氯与叠氮化钠反应,氯被叠氮基取代,生成酰基叠氮。
- 酰基叠氮发生Curtius重排反应生成异氰酸酯。
- 异氰酸酯经Schmidt反应水解为2-苯基环丙胺,即反苯环丙胺。
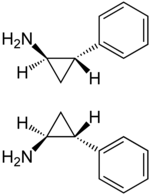
此时得到的是四种立体异构体的混合物。通过与手性的酒石酸结晶拆分,即可得到所需的(1S,2R)-和(1R,2S)-反式-2-苯基环丙胺两种异构体的混合物。
参考资料
[编辑]- ^ 1.0 1.1 1.2 Williams, David A. Antidepressants. Foye, William O.; Lemke, Thomas L.; Williams, David A. (编). Foye's Principles of Medicinal Chemistry. Hagerstwon, MD: Lippincott Williams & Wilkins. 2007: 590–1 [2009-09-03]. ISBN 0-7817-6879-9. (原始内容存档于2017-09-08).
- ^ 2.0 2.1 Ulrich, Sven; Ricken, Roland; Adli, Mazda. Tranylcypromine in mind (Part I): Review of pharmacology. European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 08 2017, 27 (8): 697–713 [2018-10-17]. ISSN 1873-7862. PMID 28655495. doi:10.1016/j.euroneuro.2017.05.007. (原始内容存档于2018-10-17).
- ^ Biotherapeutics - Innovative Future Medicines. Highlights from the Society of Medicines Research Symposium, held October 8, 2015 - National Heart & Lung Institute, London, UK. Drugs of the Future. 2015, 40 (11): 771. ISSN 0377-8282. doi:10.1358/dof.2015.040.11.2413472.
- ^ 4.0 4.1 4.2 Riederer, P; Laux, G (March 2011). MAO-inhibitors in Parkinson's Disease. Experimental Neurobiology. 2011,. 20 (1): 1 (1): 17 [2018-10-17]. ISSN 1226-2560. PMC 3213739
 . PMID 22110357. doi:10.5607/en.2011.20.1.1. (原始内容存档于2020-11-11) (英语).
. PMID 22110357. doi:10.5607/en.2011.20.1.1. (原始内容存档于2020-11-11) (英语).
- ^ 5.0 5.1 5.2 5.3 UK Electronic medicines compendium. Tranylcypromine (页面存档备份,存于互联网档案馆)
- ^ Gillman, PK (February 2011). "Advances pertaining to the pharmacology and interactions of irreversible nonselective monoamine oxidase inhibitors". Journal of Clinical Psychopharmacology. 31 (1): 66–74.
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 7.8 Ulrich, Sven; Ricken, Roland; Adli, Mazda. Tranylcypromine in mind (Part I): Review of pharmacology. European Neuropsychopharmacology (Elsevier BV). 2017, 27 (8): 697–713. ISSN 0924-977X. doi:10.1016/j.euroneuro.2017.05.007.
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 Gillman, Peter Kenneth. Advances Pertaining to the Pharmacology and Interactions of Irreversible Nonselective Monoamine Oxidase Inhibitors. Journal of Clinical Psychopharmacology (Ovid Technologies (Wolters Kluwer Health)). 2011, 31 (1): 66–74. ISSN 0271-0749. doi:10.1097/jcp.0b013e31820469ea.
- ^ 9.0 9.1 9.2 9.3 9.4 9.5 Ricken, Roland; Ulrich, Sven; Schlattmann, Peter; Adli, Mazda. Tranylcypromine in mind (Part II): Review of clinical pharmacology and meta-analysis of controlled studies in depression. European Neuropsychopharmacology (Elsevier BV). 2017, 27 (8): 714–731. ISSN 0924-977X. doi:10.1016/j.euroneuro.2017.04.003.
- ^ van Haelst, Ingrid M. M.; van Klei, Wilton A.; Doodeman, Hieronymus J.; Kalkman, Cor J.; Egberts, Toine C. G. Antidepressive Treatment With Monoamine Oxidase Inhibitors and the Occurrence of Intraoperative Hemodynamic Events. The Journal of Clinical Psychiatry (Physicians Postgraduate Press, Inc). 2012-07-10, 73 (08): 1103–1109. ISSN 0160-6689. doi:10.4088/jcp.11m07607.
- ^ Smith, Mark Stafford; Muir, Holly; Hall, Richard. Perioperative Management of Drug Therapy. Drugs (Springer Science and Business Media LLC). 1996, 51 (2): 238–259. ISSN 0012-6667. doi:10.2165/00003495-199651020-00005.
- ^ Blom-Peters, L; Lamy, M (1993). "Monoamine oxidase inhibitors and anesthesia: an updated literature review". Acta Anaesthesiologica Belgica. 44 (2): 57–60. PMID 8237297.
- ^ Le Gassicke, J.; Ashcroft, G. W.; Eccleston, D.; Evans, J. I.; Oswald, I.; Ritson, E. B. The Clinical State, Sleep and Amine Metabolism of a Tranylcypromine (‘Parnate’) Addict. British Journal of Psychiatry (Royal College of Psychiatrists). 1965, 111 (473): 357–364. ISSN 0007-1250. doi:10.1192/bjp.111.473.357.
- ^ Williams, David A. (2007). "Antidepressants". In Foye, William O.; Lemke, Thomas L.; Williams, David A. Foye's Principles of Medicinal Chemistry. Hagerstwon, USA: Lippincott Williams & Wilkins. pp. 590–1. ISBN 978-0-7817-6879-5.
- ^ Lee, MG; Wynder, C; Schmidt, DM; McCafferty, DG; Shiekhattar, R (June 2006). "Histone H3 lysine 4 demethylation is a target of nonselective antidepressive medications". Chemistry & Biology. 13 (6): 563–7.
- ^ Mast, Natalia; Charvet, Casey; Pikuleva, Irina A.; Stout, C. David. Structural Basis of Drug Binding to CYP46A1, an Enzyme That Controls Cholesterol Turnover in the Brain. Journal of Biological Chemistry (Elsevier BV). 2010, 285 (41): 31783–31795. ISSN 0021-9258. doi:10.1074/jbc.m110.143313.
- ^ Sherry, R.L; Rauw, G; McKenna, K.F; Paetsch, P.R; Coutts, R.T; Baker, G.B. Failure to detect amphetamine or 1-amino-3-phenlypropane in humans or rats receiving the MAO inhibitor tranylcypromine. Journal of Affective Disorders (Elsevier BV). 2000, 61 (1-2): 23–29. ISSN 0165-0327. doi:10.1016/s0165-0327(99)00188-3.
- ^ V.J. Rajadhyaksha, US Patent 4016204 (1977).
- ^ A. Burger, W.L.L. Yost. Arylcycloalkylamines. I. 2-Phenylcyclopropylamine. J. Am. Chem. Soc. 1948, 70: 2198. doi:10.1021/ja01186a062.