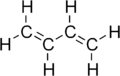丁二烯
| 1,3-丁二烯 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 1,3-丁二烯 | |||
| 别名 | 1,3-丁二烯、二乙烯、联乙烯 | ||
| 识别 | |||
| CAS号 | 106-99-0 | ||
| PubChem | 7845 | ||
| ChemSpider | 7557 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | KAKZBPTYRLMSJV-UHFFFAOYAZ | ||
| UN编号 | 1010 | ||
| EINECS | 271-039-0 | ||
| ChEBI | 39478 | ||
| RTECS | EI9275000 | ||
| KEGG | C16450 | ||
| 性质 | |||
| 化学式 | C4H6 | ||
| 摩尔质量 | 54.0916 g·mol⁻¹ | ||
| 外观 | 无色气体 或冷冻液体 | ||
| 气味 | 轻度芳香或类似汽油 | ||
| 密度 | 0.6149 g/cm3 at 25 °C, 固体 0.64 g/cm3 at −6 °C, 液体 | ||
| 熔点 | −108.9 °C, 164.3 K, −164.0 °F | ||
| 沸点 | −4.4 °C(269 K) | ||
| 溶解性(水) | 0.735 g/100 mL | ||
| 溶解性 | 非常易溶于丙酮 溶于乙醚,乙醇 | ||
| 折光度n D |
1.4292 | ||
| 黏度 | 0.25 cP at 0 °C | ||
| 危险性 | |||
| 警示术语 | R:R45 R46 R12 | ||
| 安全术语 | S:S45 S53 | ||
| MSDS | ECSC 0017 | ||
| 主要危害 | 易燃,有刺激性,致癌物质 | ||
| NFPA 704 | |||
| 爆炸极限 | 2–12% | ||
| 致死量或浓度: | |||
LD50(中位剂量)
|
548 mg/kg(大鼠,口服) | ||
| 相关物质 | |||
| 相关烯烃 和 二烯烃 |
异戊二烯 氯丁二烯 | ||
| 相关化学品 | 丁烷 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
1,3-丁二烯简称丁二烯,是分子式为C4H6的有机化合物,一种重要的化工原料,可作为单体用于制造合成橡胶(丁苯橡胶、顺丁橡胶、丁腈橡胶、氯丁橡胶)。当这个词丁二烯被使用的情况下,大多数时候是指1,3 - 丁二烯。
这个名称丁二烯还可以指同分异构体:1,2-丁二烯,它是一个累积二烯烃。然而,这种丁二烯难以制备,并且没有工业价值。
历史
[编辑]法国化学家E. Caventou于1863年从戊醇热分解的产物中分离丁二烯。[1]它之后由亨利·爱德华·阿姆斯特朗在1886年从石油分离并确认。[2]
结构
[编辑]
1,3-丁二烯分子中,碳原子都是以sp2方式杂化成键,每个碳原子还有一个垂直于分子平面的p轨道,相互平行重叠构成一个离域大π键。 1,3-丁二烯的最稳定构象是s-反式构象,两对双键分别处于C-C单键的两侧,此时空间效应最小,两种构象的能垒相差24.8 kJ/mol(5.9 kcal/mol)。[3]
即使1,3-丁二烯的s-顺式构象有更高的能量,但仍会以此构象作为四电子组分参与协同的环加成反应,如Diels-Alder反应。
经过实验和计算,s-反-1,3-丁二烯的双键键长为133.8pm,而乙烯中的碳碳双键键长为133.0pm,这也被认为是π键被离域效应削弱和增长的证据,可见如图所示的共振结构式。[4]

并且,1,3-丁二烯中的碳碳单键的键长也明显小于烷烃中碳碳单键的键长,这种现象被称为键长的平均化,是共轭烯烃的特征之一。
性质
[编辑]丁二烯是无色有微弱芳香气味的无色易液化气体,难溶于水,可溶于醇、醚、丙酮、苯等有机溶剂。在氧气存在下容易发生聚合。
1,3-丁二烯分子中的碳-碳单键可以自由旋转,但无顺式和反式异构体。丁二烯还有另一种异构体:1,2-丁二烯,它是一个累积二烯烃,与1,3-丁二烯相比非常不稳定。
丁二烯是狄尔斯-阿尔德反应常用的双烯体之一,它与缺电子亲双烯体发生狄尔斯-阿尔德反应,可以制取蒽醌、四氢苯酐、丁烷四羧酸、六氢苯二甲酸酐等很多化工产品。丁二烯也可以与二氧化硫发生螯变反应,然后加氢生成工业溶剂环丁砜。
当把丁二烯通入溴水,起加成反应时,除了生成溴直接和双键加成生成的1-二溴丁烯外,还生成2-二溴丁烯——在加成时,两个双键中比较活泼的键一起断裂,同时生成新的双键。如果丁二烯通入得较慢,而且溴水又多又浓,最后会生成1,1,3,3-四溴丁烷。
生产
[编辑]丁二烯的工业生产方法有:
从C4烃提取
[编辑]此法目前应用于美国、西欧和日本。乙烯装置副产C4抽提(脂肪烃于900°C以上发生水蒸气裂解制取乙烯和其他烯烃时的副产品)。此法正逐步替代其他方法,成为制取丁二烯的主要方法。生成的丁二烯可通过乙腈或二甲基甲酰胺等极性非质子溶剂萃取出来,并蒸馏提纯。[5]
从正丁烷的脱氢
[编辑]通过丁烷或丁烯催化脱氢生产。首个用此丁烷脱氢法生产丁二烯的工厂于1957年建于美国休斯顿,年产65000吨丁二烯。此法正被逐步淘汰。
从乙醇
[编辑]参见
[编辑]参考资料
[编辑]- ^ Caventou, E. Ueber eine mit dem zweifach-gebromten Brombutylen isomere Verbindung und über die bromhaltigen Derivate des Brombutylens. Justus Liebigs Annalen der Chemie. 1863, 127: 93–97 [2022-12-12]. doi:10.1002/jlac.18631270112. (原始内容存档于2022-12-12).
- ^ Armstrong, H. E.; Miller, A. K. The decomposition and genesis of hydrocarbons at high temperatures. I. The products of the manufacture of gas from petroleum. J. Chem. Soc. 1886, 49: 74–93 [2022-12-12]. doi:10.1039/CT8864900074. (原始内容存档于2022-12-12).
- ^ Feller, David; Craig, Norman C. High Level ab Initio Energies and Structures for the Rotamers of 1,3-Butadiene. The Journal of Physical Chemistry A. 2009-02-26, 113 (8): 1601–1607. Bibcode:2009JPCA..113.1601F. ISSN 1089-5639. PMID 19199679. doi:10.1021/jp8095709 (英语).
- ^ Craig, Norman C.; Groner, Peter; McKean, Donald C. Equilibrium Structures for Butadiene and Ethylene: Compelling Evidence for Π-Electron Delocalization in Butadiene. The Journal of Physical Chemistry A. 2006-06-01, 110 (23): 7461–7469. Bibcode:2006JPCA..110.7461C. ISSN 1089-5639. PMID 16759136. doi:10.1021/jp060695b.
- ^ Sun, H.P. Wristers, J.P. (1992). Butadiene. In J.I. Kroschwitz (Ed.), Encyclopedia of Chemical Technology, 4th ed., vol. 4, pp. 663–690. New York: John Wiley & Sons.
- ^ Kirshenbaum, I. (1978). Butadiene. In M. Grayson (Ed.), Encyclopedia of Chemical Technology, 3rd ed., vol. 4, pp. 313–337. New York: John Wiley & Sons.
- ^ 丁二烯字典-Guidechem.com(英文). [2012-01-09]. (原始内容存档于2020-11-07).