表面能

表面能(英語:Surface energy)是形成物質表面時破壞分子間作用力所需消耗的能量。在固體物理理論中,表面原子比物質內部的原子具有更多的能量,因此根據能量最低原理,原子會自發趨於物質內部而不是表面。表面能的另一種定義是,材料表面相對於材料內部的除共有的、所具有的較其多的能量。由於把一個固體材料分解成小塊需要破壞它內部的分子間作用力,所以需要消耗能量。如果這個分解的過程是可逆的,那麼把材料分解成小塊所需要的能量就和小塊材料表面所增加的能量相等。但事實上,只有在真空中剛形成的表面才符合上述能量守恆。這是因為,新形成的表面是非常不穩定的,它們通過表面原子重組和相互間的反應,或者對周圍其他分子或原子的吸附,從而使表面能量降低。
表面能的測定
[編輯]通過接觸角測量來測量表面能
[編輯]測量表面能的最常見方法是通過接觸角實驗。[1]在這種方法中,用幾種液體(通常是水和二碘甲烷)測量表面的接觸角。基於接觸角的結果和已知道液體的表面張力,可以計算表面能。 實際上,這種分析是通過接觸角儀自動完成的。[2]
有幾種不同的模型可根據接觸角讀數計算表面能。[3]最常用的方法是OWRK法(Owens-Wendt-Rabel-Kaelble法),它需要使用兩種探測液,並給出總的表面能並將其分為極性和分散成分。
接觸角法是一種簡單的表面能測量方法,因為它具有簡便性,適用於各種表面以及快速的特性。測量可以完全自動化並且是標準化的。[4]
測量固體的表面能–其他方法
[編輯]液體的表面能可以通過拉伸液體膜來測量(這增加了表面積並因此增加了表面能)。在那種情況下,為了使一定量的液體的表面積增加δA,需要功的量γ δA(其中,γ是液體的表面能密度)。但是,這樣的方法不能用於測量固體的表面能,因為固體膜的拉伸除了增加表面能之外,還會在主體中誘發彈性能。
固體的表面能通常在高溫下測量。在這樣的溫度下,固體潛變,即使表面積改變,體積也保持大致恆定。如果γ是半徑為r和長度為l的圓柱棒在高溫和恆定單軸張力P下的表面能密度,則在平衡時,總亥姆霍茲自由能的變分法消失,可以得到
其中F是亥姆霍茲自由能,A是棒的表面積:
而且,由於杆的體積(V)保持恆定,所以體積的變化(δV)為零,即:
因此,表面能密度可以表示為:
可以通過在平衡狀態下測量P,r和l來計算固體的表面能密度。
該方法僅在固體是各向同性的情況下才有效,這意味著所有晶體學取向的表面能都相同。儘管這僅對非晶態固體(玻璃)和液體嚴格適用,但各向同性是許多其他材料的良好近似值。特別是,如果樣品是多顆粒的(大多數金屬)或通過粉末燒結製成的(大多數陶瓷),則這是一個很好的近似值。
在單晶材料(例如天然寶石)的情況下,表面能的各向異性會導致切面。晶體的形狀(假設熱力學平衡生長條件)與伍爾夫構型(Wulff construction)的表面能有關。因此,通過測量刻面的相對尺寸,可以發現刻面的表面能在比例常數內。
計算變形固體的表面能
[編輯]在固體變形中,表面能可被視為「產生一個單位表面積所需的能量」,並且是變形前後系統總能量之差的函數:
- .
根據從頭計算法(例如密度泛函理論)計算表面能是測量的另一種方法。表面能根據以下變量估算:
d波段的寬度,d價電子數量以及固體表面和主體中原子的配位數。[5]
計算結晶固體的表面形成能
[編輯]在密度泛函理論中,可以根據以下表達式計算表面能:
其中
- Eslab是使用密度泛函理論獲得的表面平板的總能量。
- N是表面平板中的原子數。
- Ebulk是每個原子的總能量。
- A是表面積。
對於一個平板,有兩個曲面,它們是同一類型,這在分母中用數字2來表示。為了保證這一點,需要仔細創建樓板,以確保上下表面的類型相同。
粘合接觸的強度取決於粘合功,也稱為兩個接觸體的相對表面能。[6]相對表面能可以通過將由一種材料製成的形狀明確的物體與由第二材料製成的基板分離來確定。[7]例如,「有機玻璃-明膠」界面的相對表面能等於0.03 N / m。 在視頻中可以看到用於測量相對表面能及其功能的實驗裝置。[8]
從升華熱估算表面能
[編輯]為了保證估算的準確,均勻材料的表面能,可以將材料的單個分子成分建模為立方體。需要能量將立方體從大部分材料中移動到表面。能源成本被納入材料的表面能,可以通過以下方式量化:

其中zσ和zβ是與材料的表面和主體區域相對應的配位數,分別等於5和6; a0是單個分子的表面積,WAA是成對的分子間能。
可以通過對分子體積的立方根求平方來確定表面積:
此處,M̄對應於分子的摩爾質量,ρ對應於密度,NA是阿伏伽德羅數。
為了確定成對的分子間能量,必須破壞材料中的所有分子間力。這樣可以更全面的研究單個分子發生的相互作用。在物質升華過程中,分子之間的分子間作用力被破壞,導致材料從固體變為氣體。因此,在確定成對的分子間能時,考慮到升華焓是有用的。升華焓可以通過以下公式計算:
使用經驗表式的升華焓值,可以確定成對的分子間能量。將該值結合到表面能方程中可以估算表面能。
下列方程式可以用作表面能的合理估計:
界面能
[編輯]界面的存在通常會影響系統的所有熱力學參數。有兩種常用的模型來演示界面現象:Gibbs理想界面模型和Guggenheim模型。為了使用吉布斯模型演示界面系統的熱力學,該系統可以分為三個部分:兩種具有體積Vα和Vβ的不混溶的液體,以及一個無限薄的邊界層,稱為Gibbs劃分平面(σ),將這兩個體積分開。

系統的總容量為:
系統的所有擴展量都可以寫為三個組成部分的總和:體相α,體相β和界面σ。一些示例也包括內部能量U,第i個物質ni的分子數和熵S。
儘管這些量在每個組件之間可以變化,但是系統內的總和保持恆定。在界面上,這些值可能會與本體階段中存在的值有所不同。界面處存在的分子濃度可以定義為:
其中ciα和ciβ分別代表物質i在本體相α和β中的濃度。
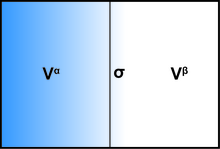
定義一個新的術語界面過量Γi是有益的,因此可以描述每單位面積的分子數量:
潤濕性
[編輯]傳播參數
[編輯]表面能在潤濕現象中起作用。要對此進行檢查,請考慮在固態基材上滴一滴液體。如果基材的表面能在添加液滴後發生變化,則稱基材潤濕。擴頻參數可用於數學確定:
其中S是擴展參數,γs是基底的表面能,γl是液體的表面能,γs-l是基底和液體之間的界面能。
若S < 0,則液體會部分潤濕基材。 若S > 0,則液體將基板完全潤濕。[9]
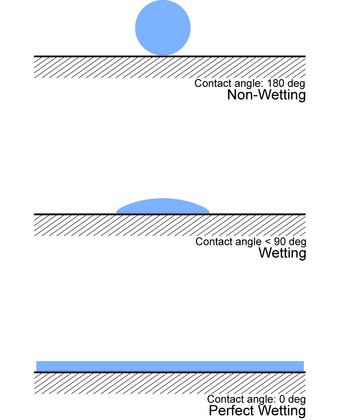
接觸角
[編輯]實驗確定潤濕性的一種方法是查看接觸角(θ),即連接固液界面和液氣界面的角度(如圖所示)。
- 若θ = 0°,則液體會完全潤濕基材。
- 若0° < θ < 90°,則發生高潤濕。
- 若90° < θ < 180°,則發生低潤濕。
- 若θ = 180°,則液體根本不會潤濕基材。[10]
浸潤將接觸角與界面能聯繫起來:
其中,γs-g是固相和氣相之間的界面能,γs-l底物與液體之間的界面能,γl-g是液相和氣相之間的界面能,θ是固液界面與液氣界面的接觸角。[11]
高能和低能底物的潤濕
[編輯]固體基質的主體成分的能量取決於將基質固定在一起的相互作用的類型。高能基片通過鍵保持在一起,而低能基片通過力保持在一起。共價鍵,離子鍵和金屬鍵比諸如范德華力和氫鍵的作用力強得多。高能量的基材比低能量的基材更容易潤濕。[12]另外,如果基底具有比液體高得多的表面能,則將發生更完全的潤濕。[13]
表面能改性技術
[編輯]最常用的表面改性方案是電漿體活化,濕化學處理(包括接枝)和薄膜塗層。[14][15][16]模擬表面能是一種使器件製造和包括圖案化在內的表面修飾可以合併到使用單個器件材料的單個處理步驟中的技術。[17]
可以使用許多技術來增強潤濕性。可以使用諸如電暈處理[18],電漿處理和酸蝕刻之類的表面處理[19]來增加基板的表面能。也可以將添加劑添加到液體中以降低其表面能。該技術通常用於油漆配方中,以確保將它們均勻地鋪展在表面上。[20]
開爾文方程
[編輯]由於液體固有的表面張力,形成彎曲的表面以最小化面積。這種現象是由形成表面的高能成本引起的。這種情況下,當曲面彎曲時,系統的吉布斯自由能被最小化。

開爾文方程式基於熱力學原理,用於描述由曲面液體引起的蒸氣壓變化。蒸氣壓發生這種變化的原因是拉普拉斯壓力。液滴的蒸氣壓高於平面的蒸氣壓,因為增加的拉普拉斯壓力使分子更容易蒸發。相反,在氣泡周圍的液體中,相對於氣泡內部的壓力降低,從而使分子更難以蒸發。開爾文方程式表示為:
其中,PK
0是曲面的蒸氣壓,P0是平面的蒸氣壓,γ是表面張力,Vm是液體的摩爾體積,R是通用氣體常數,T是溫度(以開爾文為單位),R1和R2是表面曲率的主要半徑。
塗料的表面改性顏料
[編輯]顏料在改變塗料的應用性能方面具有巨大的潛力。由於其細粒度和固有的高表面能,其通常需要進行表面處理,以增強在液體介質中的分散性。以前已經使用了各種各樣的表面處理方法,包括在存在極性基團的情況下分子表面上的吸附,聚合物的單層以及有機顏料表面上的無機氧化物層。[21]
隨著較大的顏料顆粒分解成較小的子顆粒,新表面不斷產生。因此,這些新形成的表面會產生更大的表面能,從而使生成的顆粒經常粘在一起形成聚集體。由於分散在液體介質中的顆粒處於恆定的熱運動或布朗運動中,因此當其在介質中移動並發生碰撞時,其對附近的其他顏料顆粒具有很強的親和力。[21]這種自然吸引力主要歸功於強大的短程范德華力,這是其表面能的作用。
顏料分散的主要目的是分解聚集體並形成最佳尺寸顏料顆粒的穩定分散體。該過程通常涉及三個不同的階段:潤濕,分解和穩定。當配製要求良好的粘附性和外觀的塗料時,易於潤濕的表面是理想的。這也使與表面張力有關的缺陷(例如爬行,起皺和橘皮)的風險最小化。[22]這是顏料分散體的基本要求。 為了使潤濕有效,顏料載體的表面張力必須低於顏料的表面自由能。[21]這使載體滲入顏料聚集體的空隙中,從而確保完全潤濕。最後,使顆粒受到排斥力,以使它們彼此分離並降低絮凝的可能性。
分散體可能通過兩種不同的現象變得穩定:電荷排斥和空間或熵排斥。[22]在電荷排斥中,具有相同電荷的粒子彼此排斥。或者,當分散體中的顏料顆粒的表面上存在被吸附的材料層(例如被溶劑溶脹的聚合物分子)時,位阻排斥或熵排斥是用來描述排斥作用的現象。僅聚合物分子的某些部分(錨)被吸附,它們相應的環和尾部延伸到溶液中。當顆粒彼此接近時,其的吸附層變得擁擠。 這提供了有效的空間屏障,可防止絮凝。[23]這種擁擠效應伴隨著熵的降低,由此減少了在吸附層中聚合物分子可能的構象數目。結果,能量增加並且經常產生排斥力,該排斥力有助於使顆粒彼此分離。

常用表面能值表
[編輯]| 材料 | 方向 | 表面能(mJ/m2) |
|---|---|---|
| 聚四氟乙烯(PTFE) | 19[24] | |
| 玻璃 | 83.4[25] | |
| 石膏 | 370[26] | |
| 銅 | 1650[27] | |
| 氧化鎂 | (100) 水平 | 1200[28] |
| 氟化鈣 | (111) 水平 | 450[28] |
| 氟化鋰 | (100) 水平 | 340[28] |
| 碳酸鈣 | (1010) 水平 | 23[28] |
| 氯化鈉 | (100) 水平 | 300[29] |
| 氯化鈉 | (110) 水平 | 400[30] |
| 氯化鉀 | (100) 水平 | 110[29] |
| 氟化鋇 | (111) 水平 | 280[28] |
| 矽 | (111) 水平 | 1240[28] |
瀏覽更多
[編輯]- 接觸角(Contact angle (頁面存檔備份,存於網際網路檔案館))
- 表面張力(Surface tension (頁面存檔備份,存於網際網路檔案館))
參考資料
[編輯]- ^ Marshall, S. J.; Bayne, S. C.; Baier, R.; Tomsia, A. P.; Marshall, G. W. A review of adhesion science. Dental Materials. 2010, 26 (2): e11–e16. PMID 20018362. doi:10.1016/j.dental.2009.11.157 (英語).
- ^ Laurén, S. How To Measure Surface Free Energy?. blog.biolinscientific.com. Biolin Scientific. [2019-12-31]. (原始內容存檔於2019-12-31) (英語).
- ^ Surface Free Energy: Measurements. biolinscientific.com. Biolin Scientific. [2019-12-31]. (原始內容存檔於2021-05-04) (英語).
- ^ ISO 19403-2:2017. Paints and varnishes — Wettability — Part 2: Determination of the surface free energy of solid surfaces by measuring the contact angle. ISO. 2017 [2021-05-02]. (原始內容存檔於2021-05-02).
- ^ Woodruff, D. P. (編). The Chemical Physics of Solid Surfaces 10. Elsevier. 2002.[缺少ISBN]
- ^ Contact Mechanics and Friction: Physical Principles and Applications. Springer. 2017. ISBN 9783662530801.
- ^ Popov, V. L.; Pohrt, R.; Li, Q. Strength of adhesive contacts: Influence of contact geometry and material gradients. Friction. September 2017, 5 (3): 308–325. doi:10.1007/s40544-017-0177-3 (英語).
- ^ Dept. of System Dynamics and Friction Physics. Science friction: Adhesion of complex shapes. December 6, 2017 [2018-01-28]. (原始內容存檔於2021-05-07).
- ^ Bonn, D.; Eggers, J.; Indekeu, J.; Meunier, J.; Rolley, E. Wetting and Spreading. Reviews of Modern Physics. 2009, 81 (2): 739–805 [2021-05-13]. Bibcode:2009RvMP...81..739B. doi:10.1103/revmodphys.81.739. (原始內容存檔於2021-05-13).
- ^ Zisman, W. Relation of the Equilibrium Contact Angle to Liquid and Solid Constitution. Advances in Chemistry Series. Advances in Chemistry. 1964, 43: 1–51. ISBN 0-8412-0044-0. doi:10.1021/ba-1964-0043.ch001.
- ^ Owens, D. K.; Wendt, R. C. Estimation of the Surface Free Energy of Polymers. Journal of Applied Polymer Science. 1969, 13 (8): 1741–1747. doi:10.1002/app.1969.070130815.
- ^ De Gennes, P. G. Wetting: statics and dynamics. Reviews of Modern Physics. 1985, 57 (3): 827–863. Bibcode:1985RvMP...57..827D. doi:10.1103/revmodphys.57.827.
- ^ Kern, K.; David, R.; Palmer, R. L.; Cosma, G. Complete Wetting on 'Strong' Substrates: Xe/Pt(111). Physical Review Letters. 1986, 56 (26): 2823–2826. Bibcode:1986PhRvL..56.2823K. PMID 10033104. doi:10.1103/physrevlett.56.2823.
- ^ Becker, H.; Gärtner, C. Polymer microfabrication technologies for microfluidic systems. Analytical and Bioanalytical Chemistry. 2007, 390 (1): 89–111. PMID 17989961. doi:10.1007/s00216-007-1692-2.
- ^ Mansky. Controlling Polymer-Surface Interactions with Random Copolymer Brushes. Science. 1997, 275 (5305): 1458–1460. doi:10.1126/science.275.5305.1458.
- ^ Rastogi. Direct Patterning of Intrinsically Electron Beam Sensitive Polymer Brushes. ACS Nano. 2010, 4 (2): 771–780. PMID 20121228. doi:10.1021/nn901344u.
- ^ Pardon, G.; Haraldsson, T.; van der Wijngaart, W. Surface Energy Mimicking: Simultaneous Replication of Hydrophilic and Superhydrophobic Micropatterns through Area-Selective Monomers Self-Assembly. Advanced Materials Interfaces. 2016, 3 (17): 1600404. doi:10.1002/admi.201600404.
- ^ Sakata, I.; Morita, M.; Tsuruta, N.; Morita, K. Activation of Wood Surface by Corona Treatment to Improve Adhesive Bonding. Journal of Applied Polymer Science. 2003, 49 (7): 1251–1258. doi:10.1002/app.1993.070490714.
- ^ Rosales, J. I.; Marshall, G. W.; Marshall, S. J.; Wantanabe, L. G.; Toledano, M.; Cabrerizo, M. A.; Osorio, R. Acid-etching and Hydration Influence on Dentin Roughness and Wettability. Journal of Dental Research. 1999, 78 (9): 1554–1559. PMID 10512390. doi:10.1177/00220345990780091001.
- ^ Khan, H.; Fell, J. T.; Macleod, G. S. The influence of additives on the spreading coefficient and adhesion of a film coating formulation to a model tablet surface. International Journal of Pharmaceutics. 2001, 227 (1–2): 113–119. PMID 11564545. doi:10.1016/s0378-5173(01)00789-x.
- ^ 21.0 21.1 21.2 Wicks, Z. W. Organic Coatings: Science and Technology 3rd. New York: Wiley Interscience. 2007: 435–441.
- ^ 22.0 22.1 Tracton, A. A. Coatings Materials and Surface Coatings 3rd. Florida: Taylor and Francis Group. 2006: 31–6 – 31–7.
- ^ Auschra, C.; Eckstein, E.; Muhlebach, A.; Zink, M.; Rime, F. Design of new pigment dispersants by controlled radical polymerization. Progress in Organic Coatings. 2002, 45 (2–3): 83–93. doi:10.1016/s0300-9440(02)00048-6.
- ^ Kinloch, A. J. Adhesion & Adhesives: Science & Technology. London: Chapman & Hall. 1987.[缺少ISBN]
- ^ Rhee, S.-K. Surface energies of silicate glasses calculated from their wettability data. Journal of Materials Science. 1977, 12 (4): 823–824. Bibcode:1977JMatS..12..823R. S2CID 136812418. doi:10.1007/BF00548176.
- ^ Dundon, M. L.; Mack, E. The Solubility and Surface Energy of Calcium Sulfate. Journal of the American Chemical Society. 1923, 45 (11): 2479–2485. doi:10.1021/ja01664a001.
- ^ Udin, H. Grain Boundary Effect in Surface Tension Measurement. JOM. 1951, 3 (1): 63. Bibcode:1951JOM.....3a..63U. doi:10.1007/BF03398958
 .
.
- ^ 28.0 28.1 28.2 28.3 28.4 28.5 Gilman, J. J. Direct Measurements of the Surface Energies of Crystals. Journal of Applied Physics. 1960, 31 (12): 2208. Bibcode:1960JAP....31.2208G. doi:10.1063/1.1735524.
- ^ 29.0 29.1 Butt, H.-J.; Graf, Kh.; Kappl, M. Physics and Chemistry of Interfaces. Weinheim: Wiley-VCH. 2006.[缺少ISBN]
- ^ Lipsett, S. G.; Johnson, F. M. G.; Maass, O. The Surface Energy and the Heat of Solution of Solid Sodium Chloride. I. Journal of the American Chemical Society. 1927, 49 (4): 925. doi:10.1021/ja01403a005.

















