生物正交化學
此條目翻譯品質不佳。 (2016年8月21日) |
生物正交化學(英語:Bioorthogonal chemistry)指能夠在生物系統中發生而且不干擾內源性生物化學過程的化學反應。[1][2][3] 該術語是由美國化學家卡羅琳·貝爾托西於2003年創造的反應。[4]生物正交反應使得對生物體內的生物分子(如糖類、蛋白質[5]和脂類[6]等)的實時研究成為可能。在目前,已發展了大量滿足生物正交性的化學偶聯策略,如疊氮化合物與環炔烴的1,3-偶極環加成反應(又稱無銅點擊化學)[7]、硝酮與環炔烴的反應[8]、醛或酮形成肟或腙的反應[9]、四嗪與環狀烯烴或環狀炔烴的狄爾斯-阿爾德反應[10]、基於異氰化物的點擊反應[11],以及四環烷偶聯反應[12]。

生物正交化學的使用通常分兩個步驟進行。 第一步,用生物正交官能團(化學報告者)修飾細胞底物並將其引入細胞; 底物包括代謝物、酶抑制劑等。化學報告者分子不得顯著改變底物的結構,以免影響其生物活性。 第二步,引入含有互補官能團的探針來反應並標記底物。
儘管已經開發出有效的生物正交反應(例如無銅點擊化學),但新反應的開發仍在繼續產生正交標記方法,以允許在同一生物系統中使用多種標記方法。 卡羅琳·貝爾托西因其對點擊化學和生物正交化學的發展而榮獲2022年諾貝爾化學獎[13]。
生物正交性的要求
[編輯]滿足生物正交性的化學反應必須滿足如下要求:
- 選擇性: 反應必須選擇性地與目標分子發生反應,沒有副反應
- 生物學惰性: 反應物與產物不能干擾內源性生物化學過程。
- 化學惰性:發生偶聯的共價鍵必須足夠穩定,不受內源性生物化學反應影響。
- 動力學: 反應必須快速進行,以滿足活體實時研究的需要。
- 反應生物兼容性:反應必須是無毒的,並且必須在考慮 pH 值、水環境和溫度的生物條件下發揮作用。 隨著生物正交化學擴展到活體動物模型,藥物動力學越來越受到關注。
- 可操作性: 化學報告分子必須可通過新陳代謝或蛋白質工程等方法引入到生物分子上。通常所引入的官能團要足夠小,以免干擾生物分子的生物學功能。
施陶丁格偶聯反應
[編輯]施陶丁格偶聯反應是由貝爾托西課題組於2000年基於施陶丁格反應發展而來。[14]
生物正交性
[編輯]疊氮化物是一種軟親電試劑,因此更傾向於與軟親核試劑膦反應(與多數生物體內親核體相比)。該反應有很高的選擇性,可在水相進行,生成穩定產物。
由於膦不是天然存在於生物體內的化合物,而且也不會還原二硫鍵,因此避免了副反應的發生。
有機疊氮化物已被證明具有很好的生物兼容性,比如疊氮胸苷早已是FDA批准的藥物。疊氮基團由於分子體積小,易於通過新陳代謝引入到生物分子上。
機理
[編輯]傳統的施陶丁格反應
親核性的膦進攻疊氮基團的末端氮原子。通過一個四元環過渡態,N2離去而形成氮雜葉立德。不穩定的葉立德水解成氧化膦和伯胺。該反應不是生物正交反應,因為水解反應破壞了氮雜葉立德。
施陶丁格偶聯反應
對疊氮基團的親核進攻是限速步驟,葉立德與親電性的酯發生分子內成環反應形成五元環,最後經過水解反應形成穩定的醯胺鍵。
局限性
[編輯]膦試劑在活體內發生緩慢氧化。
該反應的動力學不夠迅速,二級反應速率常數約0.0020 M−1•s−1。可以通過在膦上添加供電子基團提高親核反應速率,但是這同時也加快了其被空氣氧化的速率。
為了彌補反應動力學上的不足,常常需要使用高濃度的膦試劑。這往往會導致成像等應用中背景信號(噪音)太高的問題。為了克服背景過高的問題,又發展了基於螢光素和螢光素的螢光膦試劑。[15]
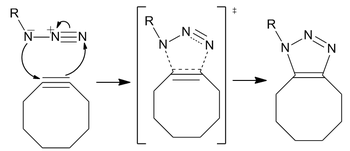
無銅(催化的)點擊化學
[編輯]無銅點擊化學不需要使用有毒的銅離子作為催化劑,同時又具有反應快速的優點,因此成為施陶丁格偶聯反應的完美替代反應(第一級反應速率提高60倍)。該反應是一種環張力促進的疊氮-炔基環加成反應(SPAAC)。
生物正交性
[編輯]儘管疊氮化物不是活性最高的1,3-偶極體,但其具有分子小、在新陳代謝過程中保持穩定、不是天然存在於生物體中,因此是一種極好的生物正交官能團。[16]
炔基雖沒有疊氮基團那麼小,但也具有穩定性和生物正交性,常用於活體內標記。[17]
反應機理
[編輯]
區域選擇性
[編輯]無銅點擊化學缺乏區域選擇性,反應產生的三唑是立體異構體混合物,但是這並不影響該反應的大多數應用。
環辛炔的發展
[編輯]| 環辛炔 | 二級反應速率常數 (M−1s−1) |
|---|---|
| OCT | 0.0024 |
| ALO | 0.0013 |
| MOFO | 0.0043 |
| DIFO | 0.076 |
| DIBO | 0.057 |
| BARAC | 0.96 |
| DIBAC (ADIBO) | 0.31 |
| DIMAC | 0.0030 |

OCT 是首個用於無銅點擊化學的環辛炔。環辛炔可在生理條件下與疊氮化物反應,並且沒有毒性。但是環辛炔水溶性差,反應速率僅僅略高於施陶丁格反應。
ALO是無芳環的環辛炔。與OCT相比水溶性有所提高,但反應動力學仍然不好。
在環辛炔的炔丙位引入吸電子效應的氟原子,可提高反應性,如單氟化的(MOFO)和雙氟化的(DIFO)環辛炔。選氟原子作為吸電子基團的優點還在於合成上的可操作性和生物兼容性的優點。同時,氟取代基不能作為親電性的麥可加成反應受體,避免了與生物體內源性親核體的副反應。[7]
二苯基環辛炔(DIBO )融合了兩個芳環,因而具有很大的環張力。雖然理論計算表明單芳環取代物可提供最優的反應空間位阻與環張力的平衡[18] ,但是單芳環取代物不夠穩定,難以實際應用。
反應性
[編輯]立體選擇性
[編輯]應用
[編輯]其他生物正交反應
[編輯]硝酮類化合物環加成反應
[編輯]降冰片烯環加成反應
[編輯]氧雜降冰片二烯環加成反應
[編輯]四嗪偶聯反應
[編輯][4+1]環加成反應
[編輯]四環庚烷偶聯反應
[編輯]
參考文獻
[編輯]- ^ Sletten, Ellen M.; Bertozzi, Carolyn R. Bioorthogonal Chemistry: Fishing for Selectivity in a Sea of Functionality. Angewandte Chemie International Edition. 2009, 48 (38): 6974–98. PMC 2864149
 . PMID 19714693. doi:10.1002/anie.200900942.
. PMID 19714693. doi:10.1002/anie.200900942.
- ^ Prescher, Jennifer A.; Dube, Danielle H.; Bertozzi, Carolyn R. Chemical remodelling of cell surfaces in living animals. Nature. 2004, 430 (7002): 873–7. PMID 15318217. doi:10.1038/nature02791.
- ^ Prescher, Jennifer A; Bertozzi, Carolyn R. Chemistry in living systems. Nature Chemical Biology. 2005, 1 (1): 13–21. PMID 16407987. doi:10.1038/nchembio0605-13.
- ^ Sletten, Ellen M.; Bertozzi, Carolyn R. From Mechanism to Mouse: A Tale of Two Bioorthogonal Reactions. Accounts of Chemical Research. 2011, 44 (9): 110815072703056. doi:10.1021/ar200148z.
- ^ Plass, Tilman; Milles, Sigrid; Koehler, Christine; Schultz, Carsten; Lemke, Edward A. Genetically Encoded Copper-Free Click Chemistry. Angewandte Chemie International Edition. 2011, 50 (17): 3878. doi:10.1002/anie.201008178.
- ^ Neef, Anne B.; Schultz, Carsten. Selective Fluorescence Labeling of Lipids in Living Cells. Angewandte Chemie International Edition. 2009, 48 (8): 1498–500. PMID 19145623. doi:10.1002/anie.200805507.
- ^ 7.0 7.1 Baskin, J. M.; Prescher, J. A.; Laughlin, S. T.; Agard, N. J.; Chang, P. V.; Miller, I. A.; Lo, A.; Codelli, J. A.; Bertozzi, C. R. Copper-free click chemistry for dynamic in vivo imaging. Proceedings of the National Academy of Sciences. 2007, 104 (43): 16793–7. PMC 2040404
 . PMID 17942682. doi:10.1073/pnas.0707090104.
. PMID 17942682. doi:10.1073/pnas.0707090104.
- ^ 8.0 8.1 Ning, Xinghai; Temming, Rinske P.; Dommerholt, Jan; Guo, Jun; Blanco-Ania, Daniel; Debets, Marjoke F.; Wolfert, Margreet A.; Boons, Geert-Jan; Van Delft, Floris L. Protein Modification by Strain-Promoted Alkyne-Nitrone Cycloaddition. Angewandte Chemie International Edition. 2010, 49 (17): 3065. doi:10.1002/anie.201000408.
- ^ Yarema, K. J.; Mahal, LK; Bruehl, RE; Rodriguez, EC; Bertozzi, CR. Metabolic Delivery of Ketone Groups to Sialic Acid Residues. APPLICATION TO CELL SURFACE GLYCOFORM ENGINEERING. Journal of Biological Chemistry. 1998, 273 (47): 31168–79. PMID 9813021. doi:10.1074/jbc.273.47.31168.
- ^ Blackman, Melissa L.; Royzen, Maksim; Fox, Joseph M. The Tetrazine Ligation: Fast Bioconjugation based on Inverse-electron-demand Diels-Alder Reactivity. Journal of the American Chemical Society. 2008, 130 (41): 13518–9. PMC 2653060
 . PMID 18798613. doi:10.1021/ja8053805.
. PMID 18798613. doi:10.1021/ja8053805.
- ^ Stöckmann, Henning; Neves, André A.; Stairs, Shaun; Brindle, Kevin M.; Leeper, Finian J. Exploring isonitrile-based click chemistry for ligation with biomolecules. Organic & Biomolecular Chemistry. 2011, 9 (21): 7303. doi:10.1039/C1OB06424J.
- ^ Sletten, Ellen M.; Bertozzi, Carolyn R. A Bioorthogonal Quadricyclane Ligation. Journal of the American Chemical Society. 2011, 133 (44): 17570–3. PMC 3206493
 . PMID 21962173. doi:10.1021/ja2072934.
. PMID 21962173. doi:10.1021/ja2072934.
- ^ The Nobel Prize in Chemistry. The Nobel Prize. [6 October 2022]. (原始內容存檔於2024-02-25).
- ^ Saxon, E.; Bertozzi, CR. Cell Surface Engineering by a Modified Staudinger Reaction. Science. 2000, 287 (5460): 2007–10. PMID 10720325. doi:10.1126/science.287.5460.2007.
- ^ Pamela, Chang.; Prescher, Jennifer A.; Hangauer, Matthew J.; Bertozzi, Carolyn R. Imaging Cell Surface Glycans with Bioorthogonal Chemical Reporters. J Am Chem Soc. 2008,. July 11; 129(27) (27): 8400–8401. PMC 2535820
 . PMID 17579403. doi:10.1021/ja070238o.
. PMID 17579403. doi:10.1021/ja070238o.
- ^ Huisgen, Rolf. 1,3-Dipolar cycloadditions. 76. Concerted nature of 1,3-dipolar cycloadditions and the question of diradical intermediates. The Journal of Organic Chemistry. 1976, 41 (3): 403. doi:10.1021/jo00865a001.
- ^ Schoenebeck, Franziska; Ess, Daniel H.; Jones, Gavin O.; Houk, K. N. Reactivity and Regioselectivity in 1,3-Dipolar Cycloadditions of Azides to Strained Alkynes and Alkenes: A Computational Study. Journal of the American Chemical Society. 2009, 131 (23): 8121–33. PMID 19459632. doi:10.1021/ja9003624.
- ^ Chenoweth, Kimberly; Chenoweth, David; Goddard Iii, William A. Cyclooctyne-based reagents for uncatalyzed click chemistry: A computational survey. Organic & Biomolecular Chemistry. 2009, 7 (24): 5255. doi:10.1039/B911482C.