雷迪帕韦/索磷布韦
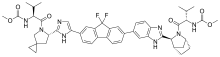 雷迪帕韦结构图 | |
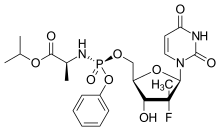 索非布韦结构图 | |
| 临床资料 | |
|---|---|
| 商品名 | Harvoni(夏奉宁)、Hepcinat-LP及其他 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a614051 |
| 核准状况 | |
| 怀孕分级 | |
| 给药途径 | 口服给药 |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 |
|
| 识别信息 | |
| PubChem CID | |
| KEGG | |
| 化学信息 | |
| 化学式 | C71H83F3N11O15P |
| 摩尔质量 | 1,418.48 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
雷迪帕韦/索磷布韦(英语:Ledipasvir/sofosbuvir),以商品名Harvoni(夏奉宁)等在市面销售,是一种用于治疗C型肝炎的药物。[8]它是由两种治疗C型肝炎的药物 - 雷迪帕韦和索磷布韦组合而成的复方药物。[8]在C型肝炎病毒 (HCV) 基因型 1感染者的治愈率为94%至99%。[9]有些证据也支持罹患HCV基因型 3和 4的患者使用。[9]患者须每天口服给药,疗程持续8-24周。[8]
通常服药者会有良好的耐受性。[10]常见的副作用有肌肉疼痛、头痛、恶心、皮疹和咳嗽。[8]目前尚不清楚个体在怀孕期间使用对胎儿是否安全。[8]雷迪帕韦透过降低NS5A的活性来发挥作用,而索磷布韦透过降低NS5B的活性来发挥作用。[8]
雷迪派韦/索磷布韦于2014年在美国、欧盟和加拿大被批准用于医疗用途。[8][11][7][12][13]此药物也被列入世界卫生组织基本药物标准清单之中。[14]
医疗用途
[编辑]基因 1型感染者的治愈率为94%至99%(基因 1型感染者占HCV病例的46%)。[15]医界还对其他C型肝炎基因型感染的治疗进行评估,虽然它在基因型 3和4(分别占HCV病例的30%和不到22%)方面的治疗显示出令人鼓舞的结果。[9][6][16][15]但尚未有最后结果出现。
抗药性
[编辑]NS5A突变
[编辑]由于多种作用机制,需要多个HCV复制子突变才能对抗药性产生显著影响。[17]一般来说,HCV基因型 1a比基因型 1b更不容易产生具抗药性的突变。[18]
对于基因型1b,复制子中的单一氨基酸(例如L31V)被取代对使用Harvoni(夏奉宁)的抗药性增加不到100倍,而两个氨基酸遭到取代则会让抗药性增加超过1,000倍。[18][19]具有基因型 1a的个体罹患C型肝炎后,随著某些关键氨基酸发生额外改变,对治疗的抗药性往往会增加。这些关键氨基酸是K24、M28、Q30、L31和Y93,任何改变(例如转换为 R、T/V、R/H/K/L、M或H/N)都可能导致病毒更难清除。[6]
NS5A的多态性也会影响病毒抗药性,在快速病毒反应 (RVR) 患者中,最常见的抗药性相关氨基酸取代位点出现在Q30R、Y93H或Y93N和L31M。[6]临床试验中观察到的特定基线NS5A(在开始HCV治疗之前,患者血液中HCV病毒基因组中NS5A蛋白的基因变异)抗药性相关多态性包括基因型 1a中的M28T/V、Q30H、Q30R、L31M、H58P、Y93H和Y93N,以及基因型 1b中的L28M、A92T和Y93H。[6]具有多个基线NS5A多态性的患者在使用雷迪帕韦/索磷布韦时往往复发率稍高。[6]患者在基线NS5A多态性存在与否,于未有治疗经验组和有治疗经验组之间,在12周疗程后复发率的差异为1%,在24周疗程后的差异为0%。[18][6]
NS5B突变
[编辑]单一胺基酸S282T取代有助于抗病毒,并将雷迪帕韦/索磷布韦之中的索磷布韦活性降低约2至18倍。[18][20]
交叉抗药性
[编辑]在ION(癌症创新研究倡议Initiative for Oncology Innovation(ION))1,2和3期临床试验中,将雷迪帕韦和索磷布韦联合使用并未发现交叉抗药性,因为雷迪帕韦能够有效抑制HCV病毒中发生的索菲布韦抗药性取代,反之亦然。[6][21]
副作用
[编辑]超过10%的患者在服用雷迪帕韦/索磷布韦后会出现头痛或疲劳,服用者中有1%至10%会出现皮疹、恶心、腹泻和失眠。[6][5]
更严重的反应与药物过敏反应和心血管问题有关。使用Harvoni较使用旧的基于干扰素的治疗相比,会有相对较轻的副作用。
雷迪帕韦/索磷布韦可能导致B型肝炎病毒和C型肝炎病毒合并感染者中B型肝炎重新活化。欧洲药品管理局建议在开始使用雷迪帕韦/索磷布韦治疗C型肝炎之前,对所有患者进行B型肝炎筛检,以尽量降低B型肝炎再活化的风险。[22]
药物交互作用
[编辑]雷迪帕韦/索磷布韦是药物运输蛋白P-糖蛋白 (P-gp) 和乳腺癌耐药蛋白 2 (BCRP) 的基质。[18]服用如利福平和贯叶连翘等诱导剂可能会降低肠道吸收这类药物运输蛋白基质的作用。[23]
也建议患者不可服用H2受体拮抗剂 (H2RA) 和氢离子帮浦阻断剂 (PPI),因为它们会降低雷迪帕韦的浓度(其溶解度取决于pH值,在酸性条件下溶解度会较高)。或是在服用雷迪帕韦/索磷布韦后至少须过两小时再服用PPI(每日剂量不超过20毫克),并建议每日服用H2RA的剂量不超过40毫克(分两次服用)。[18][24]
服用胺碘酮或其他降低心率的药物时,也应避免服用雷迪帕韦/索磷布韦,当此类药物与雷迪帕韦/索磷布韦一起使用时,会有导致心跳过缓或是停止的重大风险。[6][5]
作用机转
[编辑]与服用雷迪帕韦/索磷布韦最常见的相关机制是C型肝炎病毒非结构蛋白 5A(NS5A) 的过度磷酸化,NS5A是一种病毒聚合酶,对于正确的病毒构成非常重要,且其会干扰正常的肝脏代谢。[25]雷迪帕韦/索磷布韦透过将NS5A的亚细胞重新定位,而可抑制正确的病毒构成。[18]
C型肝炎病毒非结构蛋白 5B(NS5B)是一种可启动RNA从头开始组装的病毒聚合酶,也会被雷迪帕韦/索磷布韦异位调节作用所抑制。[26]
药物代谢动力学
[编辑]索磷布韦可在血浆中被快速吸收,给药后0.8至1小时达到最大血药浓度 (Cmax),并进行额外的肝代谢,其中61%至65%与人类血浆蛋白结合。[28][18]然后,它主要会转化为无活性的无磷酸盐循环代谢产物 - GS-331007(透过肾脏被动过滤而消除76%),其在摄入后3.5至4小时内达到中位血药浓度。[6]空腹和进食状态下服用索磷布韦似乎对其吸收不具影响。[29]
雷迪帕韦在摄取后4至4.5小时内在体内达到最大浓度,且不受常量营养素(即进食后,消化道中有碳水化合物、蛋白质、脂肪)的影响。[18][6]它会与超过98%的血浆蛋白结合,主要透过粪便排除,极少受到肝脏代谢。[6]
排除
[编辑]90毫克[添加碳-14同位素]-雷迪帕韦/索磷布韦剂量的生物半衰期为47小时,对于400毫克 [添加碳-14]-索磷布韦的生物半衰期为0.5小时(药物在身体组织中分布之后)和27小时(药物最终排出人体)。[6][30]
| 物质 | 奈克/毫升 |
|---|---|
| 雷迪帕韦 | 323 |
| 索磷布韦 | 618 |
| 循环代谢产物GS-331007 | 707 |
备注:健康个体的最大血药浓度比感染C型肝炎病毒患者的高出32%[6]
| 物质 | 奈克*小时/毫升 |
|---|---|
| 雷迪帕韦 | 7,290 |
| 索磷布韦 | 1,320 |
| 循环代谢产物GS-331007 | 12,000 |
附注:健康个体的最大血药浓度比感染C型肝炎病毒患者的高出24%[6]
血液检测
[编辑]有一种液相层析(LC)串联质谱(MS)的分析方法,可同时从人体血浆中萃取和测定雷迪帕韦/索磷布韦浓度,并使用抗病毒药物达卡他韦作为内标。此法在索磷布韦和雷迪帕韦的平均萃取回收率分别为91.61%和88.93%。[31]
社会与文化
[编辑]美国大型生物制药公司吉利德科学公司是此种药物的生产者之一。[8]该公司于2015年1-9月在Harvoni的全球销售金额估计为105亿美金(美国市场销售金额83.8亿美金)。[32]而该公司在2022年与HCV有关药物(包含Harvoni)的销售金额为18亿美金(美国市场销售金额10亿美金)。[33]
参见
[编辑]- ^ 1.0 1.1 Ledipasvir / sofosbuvir (Harvoni) Use During Pregnancy. Drugs.com. 2019-10-28 [2020-03-17]. (原始内容存档于2020-03-17).
- ^ AusPAR: Ledipasvir / Sofosbuvir. Therapeutic Goods Administration (TGA). 2015-10-29 [2020-08-29]. (原始内容存档于2022-05-07).
- ^ AusPAR: Sofosbuvir / Ledipasvir. Therapeutic Goods Administration (TGA). 2017-11-16 [2020-08-29]. (原始内容存档于2022-05-07).
- ^ Prescription medicines: registration of new chemical entities in Australia, 2015. Therapeutic Goods Administration (TGA). 2022-06-21 [2023-04-10]. (原始内容存档于2023-04-10).
- ^ 5.0 5.1 5.2 Harvoni 90 mg/400 mg film-coated tablets - Summary of Product Characteristics. UK Electronic Medicines Compendium. December 2016 [2017-02-04]. (原始内容存档于2016-10-27).
- ^ 6.00 6.01 6.02 6.03 6.04 6.05 6.06 6.07 6.08 6.09 6.10 6.11 6.12 6.13 6.14 6.15 Harvoni- ledipasvir and sofosbuvir tablet, film coated Harvoni- ledipasvir and sofosbuvir tablet, film coated Harvoni- ledipasvir and sofosbuvir pellet. DailyMed. 2020-03-16 [2020-08-29]. (原始内容存档于2023-04-17).
- ^ 7.0 7.1 Harvoni EPAR. European Medicines Agency (EMA). 2018-09-17 [2020-08-29]. (原始内容存档于2023-11-05).
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 8.7 Ledipasvir and Sofosbuvir. The American Society of Health-System Pharmacists. [2016-12-08]. (原始内容存档于2016-12-25).
- ^ 9.0 9.1 9.2 Keating GM. Ledipasvir/Sofosbuvir: a review of its use in chronic hepatitis C. Drugs. April 2015, 75 (6): 675–685. PMID 25837989. S2CID 31943736. doi:10.1007/s40265-015-0381-2.
- ^ World Health Organization. The selection and use of essential medicines. Twentieth report of the WHO Expert Committee 2015 (including 19th WHO Model List of Essential Medicines and 5th WHO Model List of Essential Medicines for Children). Geneva: World Health Organization. 2015: 69–70. ISBN 9789241209946. ISSN 0512-3054. hdl:10665/189763
 . WHO technical report series;994.
. WHO technical report series;994.
- ^ Drug Approval Package:Harvoni (ledipasvir and sofosbuvir) Tablets NDA 205834. U.S. Food and Drug Administration (FDA). 2014-11-03 [2020-08-29]. (原始内容存档于2023-11-05).
APPLICATION NUMBER: 205834Orig1s000 (PDF) (Summary Review). Center for Drug Evaluation and Research. [2024-02-01]. (原始内容存档 (PDF)于2022-12-08). - ^ Notice of Compliance (NOC) online query. 2010-08-25 [2024-02-01]. (原始内容存档于2022-05-07).
- ^ Health Canada Issues Notice of Compliance for Gilead's Harvoni (Ledipasvir/Sofosbuvir), the First Once-Daily Single Tablet Regimen for the Treatment of Genotype 1 Chronic Hepatitis C (新闻稿). Gilead Sciences, Inc. 2014-10-16 [2020-08-29]. (原始内容存档于2024-01-12) –通过Business Wire.
- ^ World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771
 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ 15.0 15.1 Messina JP, Humphreys I, Flaxman A, Brown A, Cooke GS, Pybus OG, Barnes E. Global distribution and prevalence of hepatitis C virus genotypes. Hepatology. January 2015, 61 (1): 77–87. PMC 4303918
 . PMID 25069599. doi:10.1002/hep.27259.
. PMID 25069599. doi:10.1002/hep.27259.
- ^ Holkira (Ombitasvir/Paritaprevir/ Ritonavir with Dasabuvir) and Harvoni (Ledipasvir/Sofosbuvir) for Chronic Hepatitis C: A Review of the Clinical Evidence. Rapid Response Service (Canadian Agency for Drugs and Technologies in Health). 2015-01-16. PMID 25674658. (原始内容存档于2017-11-05).
- ^ Issur M, Götte M. Resistance patterns associated with HCV NS5A inhibitors provide limited insight into drug binding. Viruses. November 2014, 6 (11): 4227–4241. PMC 4246218
 . PMID 25384189. doi:10.3390/v6114227
. PMID 25384189. doi:10.3390/v6114227  .
.
- ^ 18.0 18.1 18.2 18.3 18.4 18.5 18.6 18.7 18.8 Gritsenko D, Hughes G. Ledipasvir/Sofosbuvir (harvoni): improving options for hepatitis C virus infection. P & T. April 2015, 40 (4): 256–276. PMC 4378517
 . PMID 25859119.
. PMID 25859119.
- ^ Gao M. Antiviral activity and resistance of HCV NS5A replication complex inhibitors. Current Opinion in Virology. October 2013, 3 (5): 514–520. PMID 23896281. doi:10.1016/j.coviro.2013.06.014.
- ^ Vermehren J, Sarrazin C. The role of resistance in HCV treatment. Best Practice & Research. Clinical Gastroenterology. August 2012, 26 (4): 487–503. PMID 23199507. doi:10.1016/j.bpg.2012.09.011.
- ^ Harvoni Presribing Information (PDF). Gilead Sciences. March 2020 [2018-02-21]. (原始内容存档 (PDF)于2018-02-22).
- ^ Direct-acting antivirals indicated for treatment of hepatitis C (interferon-free). European Medicines Agency (EMA). 2018 -09-17 [2020-02-04]. (原始内容存档于2020-02-03).
- ^ Drug Interactions Between Direct-Acting anti-HCV Antivirals Sofosbuvir and Ledipasvir and HIV Antiretrovirals. www.natap.org. [2018-02-22]. (原始内容存档于2018-03-01).
- ^ Impact of Food and Antacids on Levels of Ledipasvir and Sofosbuvir. www.natap.org. [2018-02-22]. (原始内容存档于2017-01-31).
- ^ Gong G, Waris G, Tanveer R, Siddiqui A. Human hepatitis C virus NS5A protein alters intracellular calcium levels, induces oxidative stress, and activates STAT-3 and NF-kappa B. Proceedings of the National Academy of Sciences of the United States of America. August 2001, 98 (17): 9599–9604. Bibcode:2001PNAS...98.9599G. PMC 55498
 . PMID 11481452. doi:10.1073/pnas.171311298
. PMID 11481452. doi:10.1073/pnas.171311298  .
.
- ^ Lin MV, Chung R. Recent FDA approval of sofosbuvir and simeprevir. Implications for current HCV treatment. Clinical Liver Disease. March 2014, 3 (3): 65–68. PMC 6448702
 . PMID 30992888. doi:10.1002/cld.332.
. PMID 30992888. doi:10.1002/cld.332.
- ^ Pawlotsky JM. NS5A inhibitors in the treatment of hepatitis C. Journal of Hepatology. August 2013, 59 (2): 375–382. PMID 23567084. doi:10.1016/j.jhep.2013.03.030
 .
.
- ^ Sofosbuvir. www.drugbank.ca. [2018-03-23]. (原始内容存档于2018-03-24).
- ^ Cada DJ, Baker DE, Bindler RJ. Ledipasvir/Sofosbuvir. Hospital Pharmacy. March 2015, 50 (3): 224–234. PMC 4567193
 . PMID 26405313. doi:10.1310/hpj5003-224.
. PMID 26405313. doi:10.1310/hpj5003-224.
- ^ Pharmacology: Basic Pharmacology, ANS, Endocrine. www.kumc.edu. [2018-03-23]. (原始内容存档于2018-01-15).
- ^ Elkady EF, Aboelwafa AA. A Rapid and Optimized LC-MS/MS Method for the Simultaneous Extraction and Determination of Sofosbuvir and Ledipasvir in Human Plasma. Journal of AOAC International. September 2016, 99 (5): 1252–1259. PMID 27480956. doi:10.5740/jaoacint.16-0021.
- ^ Gilead Sciences Announces Third Quarter 2015 Financial Results. Gilead Sciences. 2015-10-27 [2024-01-12]. (原始内容存档于2023-09-26).
- ^ Gilead Sciences Announces Fourth Quarter and Full Year 2022 Financial Results. Gilead Sciences. 2023-02-02 [2024-01-12]. (原始内容存档于2024-01-21).
外部链接
[编辑]- Ledipasvir mixture with sofosbuvir. Drug Information Portal. U.S. National Library of Medicine. [2024-02-01]. (原始内容存档于2020-03-17).
