碳
碳(英语:Carbon;拉丁语:Carbonium,意为“煤炭”),是一种化学元素,化学符号为C,原子序数为6,原子量为12.011 u,位于元素周期表中的IV A族,属于非金属。每个碳原子有四颗能够进行键合的电子,因此其化合价通常为4。自然产生的碳由三种同位素组成:12C和13C为稳定同位素,而14C则具放射性,其半衰期约为5730年。[12]碳是少数几个自远古就被发现的元素之一(见化学元素发现年表)。[13]
碳的同素异形体有数种,最常见的包括:石墨、钻石及无定形碳。[14]这些同素异形体之间的物理性质,包括外表、硬度、电导率等等,都具有极大的差异。在正常条件下,钻石、碳纳米管和石墨烯的热导率是已知材质中最高的。
所有碳的同素异形体在一般条件下都呈固态,其中石墨的热力学稳定性最高。它们不易受化学侵蚀,甚至连氧都要在高温下才可与其反应。碳在无机化合物中最常见的氧化态为+4,并在一氧化碳及过渡金属羰基配合物中呈+2态。无机碳主要来自石灰石、白云石和二氧化碳,但也大量出现在煤、泥炭、石油和甲烷水合物等有机矿藏中。碳是所有元素中化合物种类最多的,目前有近一千万种已记录的纯有机化合物,但这只是理论上可以存在的化合物中的冰山一角。[15]
碳的丰度在地球地壳中排列第15(见地球的地壳元素丰度列表),并在全宇宙中排列第4(见化学元素丰度),名列氢、氦和氧之下。由于碳元素极为充沛,再加上它在地球环境下所能产生的聚合物种类极为繁多,因此碳是地球上所有生物的化学根本。[16]
特性
[编辑]
碳的各种同素异形体的物理特性差异极大,例如钻石是最坚硬的天然物质,而石墨则是最柔软的物质之一。碳可以和众多较小原子(包括碳原子)产生多个共价键,因此碳化合物的总数是各个元素中最高的,已发现的有近一千万种,占所有已知化合物的绝大多数。[15]碳的升华点是所有元素中最高的。在标准大气压下,碳没有熔点,因为它的三相点位于MPa、K(约4,330°C),[5][6]而是会在3,900K左右升华。[17][18]因此所有碳同素异形体的固体温度上限比熔点最高的金属还要高,如钨和钌。虽然碳能够进行氧化反应,但它的耐氧化性比铁和铜等元素都强。
碳化合物是地球上所有生物的化学基础。碳氮氧循环反应是太阳以及其他恒星内部部分能量的来源。虽然碳拥有上千万种化合物,但碳在一般条件下的化学性质并不活跃。在标准温度和压力下,碳能够抵抗几乎所有的氧化剂,并只会与最强的氧化剂反应。无论是硫酸、盐酸、氯还是任何碱,都无法侵蚀碳。在高温条件下,碳会和氧反应形成碳氧化物(CO、),也会把金属氧化物还原为纯金属,例如将氧化铁还原为游离态铁。这一放热反应应用于钢铁工业中,用以控制钢铁的碳含量:
碳能和某些金属在高温下形成碳化物,如钢铁中的Fe
3C及用作制造坚硬钻头磨料的碳化钨等。
截至2009年,石墨烯是所有已知物质中最坚固的。[19]然而从石墨中分离出石墨烯的过程需要更进一步的完善才能在工业中应用。[20]
碳的各种同素异形体有着两极化的异常特性:
| 人造钻石纳米晶体是最坚硬的物质。[21] | 石墨是最柔软的物质之一。 |
| 钻石是极佳的磨料。 | 石墨是极佳的润滑剂,甚至具超润滑性。[22] |
| 钻石是高绝缘体。[23] | 石墨是高导电体[24] |
| 钻石是导热率最高的物质之一。 | 石墨可用作热绝缘体。 |
| 钻石透明。 | 石墨为不透明黑色。 |
| 钻石晶体结构属于立方晶系。 | 石墨晶体结构属于六方晶系。[25] |
| 无定形碳具各向同性。 | 碳纳米管是各向异性最强的物质之一。 |
同素异形体
[编辑]单原子碳的存活时间极短,因此碳一般以多原子形态稳定存在,这些碳原子的不同排布方式称为同素异形体。最常见的三种碳同素异形体为无定形碳、石墨及钻石。富勒烯曾经是新发现的奇异物质,但今天已大量生产,受到了科学家的深入研究。富勒烯共包括巴基球、[26][27]碳纳米管、[28]碳纳米芽[29]及碳纳米纤维等。[30][31]其他同素异形体还有:蓝丝黛尔石、[32]玻璃碳、[33]碳纳米泡沫[34]及直链乙炔碳等等。[35]

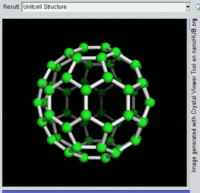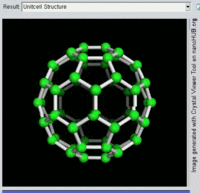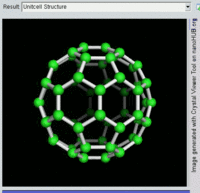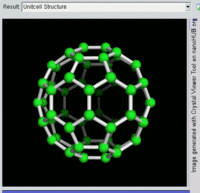
碳的无定形体是碳原子以非晶体形式不规则排列时形成的玻璃态物质,也就是不具备宏观晶体结构的石墨。无定形碳呈粉末状,是煤炭、煤烟(炭黑)及活性炭的主要成分。在正常压力下,碳以石墨的形式存在,其中每个碳原子都和另外三个碳原子键合,形成平面六边形环平铺结构。[36]这一种网状平面结构能够层叠起来,每层间有弱范德华力。因此石墨性质柔软,也可作润滑剂(因为层与层间能轻易平行滑动)。由于石墨中每个碳原子都有一颗外层离域电子,共同形成遍布整个平面的π-云,所以电能顺着石墨的每个共价键合平面上传导。因此碳的整体电导率低于大部分金属。由于含有离域电子,因此在标准条件下石墨比钻石更加稳定。

在极高压力下,碳会形成原子排布更紧密的钻石,其密度几乎为石墨的两倍。钻石中的每个碳原子以四面体状与另外四个碳原子键合,形成一个三维密铺网状结构。钻石晶体属立方晶系与硅和锗相同。由于碳-碳共价键非常强,因此钻石是最抗刮损的天然材质。虽然民间有“钻石是永恒的”一说,但实际上钻石在标准环境下并不具备热力学稳定性,而且会转变为石墨。[14]然而由于转变需要较高的活化能,所以该过程极为缓慢,肉眼无法观察。碳在某些情况下会结晶成蓝丝黛尔石。这一形态为六方晶体,所有碳原子间都以共价键键合。因此蓝丝黛尔石与钻石特性相近。[32]
富勒烯的结构与石墨相似,但除了六角碳原子环以外,它还含有五角环和七角环。这些环镶嵌成平面,卷缩成球体、椭球体和圆柱体等形状。各种富勒烯(包括巴基球、碳纳米管和碳纳米芽)的特性仍尚待研究,属于纳米材料科学的范畴。“富勒烯”(Fullerene)和“巴基球”(Buckyball)是以推广网格球顶作为建筑结构的建筑师巴克敏斯特·富勒(Buckminster Fuller)命名的,而网格球顶与富勒烯的几何结构相似。巴基球是较大的纯碳单质分子,每个碳原子与三个碳原子键合,形成椭球体(最简单的一种为足球形的,亦即巴克敏斯特富勒烯)。[26]碳纳米管则是碳原子六角形密铺平面所卷缩而成的管状(圆柱体)分子。[27][28]2007年,科学家首次宣布发现碳纳米芽,一种巴基球和碳纳米管的混合体(巴基球键合在碳纳米管壁上)。碳纳米芽同时具有巴基球和碳纳米管的属性。[29]
其他同素异形体还有碳纳米泡沫,发现于1997年,具铁磁性。碳纳米泡沫由众多碳原子低密度聚集而成,每个原子与三个碳原子键合,形成由六角或七角环串联而成的松散三维网格。它是已知最轻的固体之一,密度约为2kg/m3。[37]同样,玻璃碳也含有大量的内部气孔。[33]但与普通石墨不同,其每一层并不平行层叠,而是以相对随机的方式排布。直链乙炔碳[35]的化学结构为[35]。这一分子呈直链型,具有sp杂化轨道,是一种在三键和单键之间交替的聚合物。其杨氏模量是世\,因此在纳米科技中有相当的研究空间。[38]
存量
[编辑]


碳在全宇宙各元素中总质量排列第四,位于氢、氦和氧之后。碳大量存在于彗星、大部分行星大气层、太阳以及其他恒星中。一些陨石含有太阳系还处于原行星盘时所遗留下来的微钻石。陨石撞击时的巨大温度和压力也会在撞击坑处形成微钻石。[39]
碳与氧结合成二氧化碳,大量存在于地球大气中(当中约有8100亿吨碳)并溶解在所有水体中(约有36万亿吨碳)。整个生物圈共含有约1.9万亿吨碳。碳氢化合物(如煤、石油和天然气)同样含有碳:煤矿储备共有约9000亿吨碳,石油储备有约1500亿吨碳,而天然气则有约1050亿吨碳,但仍不包括页岩气等非常规天然气源(含有5400亿吨碳)。[40]碳也封存在地球两极和海底的甲烷水合物中,碳含量估计共有5千亿至2万5千亿吨,[41]另有研究估计含量为3万亿吨。[42]过去的碳氢化合物含量比今天要多。从1751年至2008年有大约3470亿吨碳在化石燃料燃烧过程中以二氧化碳的形式释放到大气层中。[43]
碳酸盐岩石(石灰石、白云石、大理石等等)中含有大量的碳。最大的碳矿石来源是煤,占化石燃料的80%。[44]
若以个别同素异形体计算,则石墨主要位于美国(以纽约州及德克萨斯州为主)、俄罗斯、墨西哥、格陵兰和印度。天然钻石主要出现在古火山的“颈部管道”部分的金伯利岩内。大部分钻石矿藏都位于非洲,其中以南非、纳米比亚、博茨瓦纳、刚果共和国及塞拉里昂居多。其他矿藏地点包括美国阿肯色州、加拿大、俄罗斯北极圈内、巴西以及西澳洲。好望角对出的洋底也有进行钻石的开采。虽然自然界中存在着不少钻石,但是在美国有30%的工业用钻石都是人工合成的。
宇宙射线会在海拔9至15公里的对流层和平流层处产生碳-14。[45]这一反应中,热中子撞击氮-14原子核,形成碳-14原子核及一颗质子。
同位素
[编辑]所有碳同位素的原子都有6颗质子,但中子数各异(从2到16颗不等)。碳有两个自然存在的稳定同位素:[12]碳-12()占地球上碳的98.93%,而碳-13()则占剩余的1.07%。[12]生物体中同位素的比率更高,因为生物化学反应会选择性地消除。[46]1961年,国际纯粹与应用化学联合会(IUPAC)决定以碳-12同位素作为原子量单位的定义标准。[47]核磁共振所探测的就是。
碳-14()是自然产生的放射性同位素,在地球上的丰度为一万亿分之一(0.0000000001%),主要存在于大气层和地表矿藏中,如泥炭及其他有机物质等。[48]碳-14以0.158 MeV能量进行β−衰变。由于半衰期只有5730年,所以该同位素在古老岩石中几乎绝迹,但会在大气高层(低平流层及高对流层)中经宇宙射线和氮间的反应而不断产生。[49]14C在大气层及生物体中的丰度几乎守恒,但在生物体死亡后有规律地衰减,这就是放射性碳定年法的原理。该定年法可测量年龄在4万年以下的含碳物质。[50][51]
碳有15种已知同位素,其中半衰期最短的是,它会进行质子发射,半衰期为3.5×10-21秒。[52]同位素有核晕效应,即其半径比密度均匀的正常球体原子核高得多。[53]
星体内部核合成
[编辑]碳原子核的合成需要在巨星或超巨星内部,通过3颗α粒子(氦原子核)几乎同时互相撞击而形成,称为3氦过程。进一步与氢或氦融合后分别产生的锂-5和铍-8都很不稳定,因此会迅速衰变回较小的原子核。[54]这种情况下的温度达到1亿开尔文,所需的氦浓度极高。大爆炸后的宇宙迅速膨胀、冷却,因此大爆炸没有产生大量的碳元素。赫罗图中的水平分支恒星则具备3氦过程的所需条件,可以大量生成碳。[55]超新星爆炸再将这些恒星内部的碳散布到太空中,这些含碳的尘埃聚合形成第二代、第三代恒星及其行星。太阳系属于第三代恒星系统,因此地球生物所赖以为生的碳元素,最初也是在巨大恒星的内部合成的。[56]另外,通过碳氮氧循环过程,碳作为聚变反应的催化剂,为恒星提供了绝大部分的能量。
亚毫米波天文学能够探测到含不同碳同位素的一氧化碳间的循环转换(、及),这可用于研究分子云中刚刚形成的恒星。[57]
碳循环
[编辑]
在地球上并不容易发生元素间的转变,因此地球上的碳基本上是守恒的。任何使用到碳的物理及化学过程都必须从一处取得碳,并在过程后转移到另一处。环境中碳所遵循的路径称为碳循环。例如,植物从周围环境中吸取二氧化碳,用以增加自身质量。动物可能会进食一部分植物体,并再以二氧化碳把碳还原到环境中。整个碳循环实际上复杂得多,比如一些二氧化碳会溶解在海洋中,动植物死亡后也会成为石油或煤,再经焚烧把碳还原到大气中。[58][59]
化合物
[编辑]有机化合物
[编辑]

碳能够形成串连的键,形成很长的分子链,这种特性叫做成链。碳-碳键强而稳定。因此,碳可以形成几乎无限种不同的化合物。其实,碳化合物的数量比其他所有元素的化合物加起来还要多(除氢以外,因为大部分碳化合物都含有氢)。
最简单的有机分子是碳氢化合物。这些化合物以一条碳链为主干,并有氢原子键合在碳链上。链长、支链及官能团等都会影响有机化合物的物理及化学特性。
所有生物体中都含有碳,并以碳作为有机化学的基础。碳氢化合物在工业上可用作制冷剂、润滑剂、溶剂、塑料的制造原料、化石燃料等等。
碳与氧和氢结合后,会形成众多必不可少的生物化合物,包括糖、木酯素、甲壳素、醇、脂、酯、类胡萝卜素、萜烯等等。碳与氮结合会形成生物碱,再加上硫后会形成抗生素、氨基酸及橡胶等等。最后加入磷,会形成生命所需的化学编码分子DNA及RNA,以及生物细胞用以传递能量的三磷酸腺苷(ATP)。
无机化合物
[编辑]矿石中的含碳物质以及不含氢或氟的碳化合物一般不归于有机化合物中,但这种定义并不是绝对的。这些无机化合物包括最简单的各种氧化碳,其中最重要的就是二氧化碳()。二氧化碳曾是古大气层的主要成分,但今天则只占地球大气层中的极小一部分。[60]当二氧化碳溶于水后,会形成碳酸()。但由于有多个氧原子以单键连结到一颗碳原子上,所以它并不稳定。[61]然而通过这一中继状态,因共振而稳定的碳酸盐离子得以形成。一些重要的岩石都含有碳酸盐,如石灰岩、白垩岩和大理石等。
另一常见的碳氧化物是一氧化碳(),一种在不完全燃烧后产生的无色、无味的气体。一氧化碳分子中有一个三键,而且极性非常强,所以会不可逆转地与血红蛋白分子结合,使得亲和力较低的氧无法经血红蛋白传输。[62][63]氰化物()的结构相似,但其特性更类似于卤素离子(拟卤素)。例如,氰分子()与双原子卤素相似。其他较罕见的氧化物包括二氧化三碳()、[64]不稳定的一氧化二碳()、[65][66]三氧化碳()[67][68]环戊五酮()、[69]环己六酮()[69]和苯六甲酸酐()。
当碳遇到如钨等活性较强的金属时,会形成碳化物()或乙炔化物(),大大提高这些合金的熔点。碳的电负性为2.5,[70]所以会主要形成共价键。碳有几种共价键晶格化合物,如结构与钻石相近的碳化硅()。
金属有机化合物
[编辑]金属有机化合物是任何具有碳-金属键的化合物。金属有机化合物类别繁多,主要分为烷基金属化合物(如四乙基铅)、η2烯烃化合物(如蔡斯盐)和η3烯丙基化合物(如氯化烯丙基钯二聚物);含环戊二烯配位体的茂金属(如二茂铁);以及过渡金属卡宾配合物。金属羰基配合物有很多种,包括四羰基镍等。
历史
[编辑]
中文的“碳”字为形声字,以石部表示固体非金属,并以“炭”旁表示碳元素源自木炭或煤炭等物质。韩文及日文中碳的汉字写法均为“炭素”。[71]在英文中,carbon来自拉丁文的carbo,即煤炭和木炭;[72]法文中的charbon同样也是木炭的意思。德文、荷兰文和丹麦文中碳分别写作Kohlenstoff、koolstof和kulstof,都是“炭物质”的意思。
最早的人类文明就已在煤烟和木炭中发现了碳。中国人早在公元前2500年就发现了钻石。人们在古罗马时代就开始通过在无氧环境下加热木材制造木炭。[73][74]

1722年,勒内·列奥米尔发现铁在转变为钢的过程中会吸收一种物质,今天人们知道这就是碳。[75]1772年,安东万·拉瓦锡证明钻石是完全由碳组成的。他燃烧了木炭和钻石,发现两者都没有产生水,而且形成的二氧化碳质量相同。[76]人们曾以为石墨是铅的一种形态,但卡尔·威廉·舍勒在1779年证明了它和木炭相同,但混有小量铁,并会经硝酸氧化之后释放二氧化碳。[77]1786年,法国科学家克劳德·贝托莱、加斯帕·蒙日和沙尔·奥古斯丁·范德蒙以拉瓦锡对钻石所用的方法证明,石墨同样主要由碳组成。[78]石墨在燃烧后同样留下了铁,因此他们以为铁在石墨结构中是必要的。拉瓦锡在他1789年的教科书中将碳列为化学元素。[3]
1985年,科学家发现了一种新的碳单质富勒烯,[79]其中包括巴基球、碳纳米管等等。[26]发现者罗伯特·柯尔、哈罗德·克罗托和理查德·斯莫利因此获得了1996年的诺贝尔化学奖。[80]其他奇特的碳同素异形体也被陆续发现了,例如玻璃碳。[33]
生产
[编辑]石墨
[编辑]大量天然石墨矿藏分布在世界各地,其中主要出产国为中国、印度、巴西和朝鲜。石墨矿石都是变质岩,与石英、片岩中的云母和长石、片麻岩及变质砂岩和石灰岩一同出现,呈透镜状或叶脉状,厚度可达1米多。位于英国坎伯兰博罗戴尔(Borrowdale)的石墨矿藏巨大且纯度高,直到19世纪,人们都直接锯下石墨块,削成条状后包在木条中,作铅笔出售。今天,要从较小的石墨矿中提取石墨,需要把矿石压碎后,用水浮出较轻的石墨。[81]
天然石墨以三种形式出现:无定形态、薄片状或结晶薄片状以及叶脉状或块状。无定形石墨的质量最低,但也最常见,一般被用于生产价值最低的产品。在工业中“无定形”指的是晶体细小,而非科学中所指的完全缺乏晶体结构。无定形石墨大量出现在位于中国、欧洲、墨西哥以及美国的大型矿藏中。薄片状石墨的价值更高,也较少见,通常出现在变质岩中。质量较高的薄片石墨价格可以是无定形石墨的4倍,可制成一膨胀性石墨,用作阻燃剂等。薄片石墨出产于巴西、加拿大、中国、德国和马达加斯加。叶脉状或块状石墨最为罕见,是天然石墨中质量与价格最高的一种。这种石墨整块出现在岩石与岩石之间,目前只有斯里兰卡出产。[81]
根据美国地质调查局的数据,2010年全球石墨产量为1100万吨,其中中国占了80万吨,印度13万吨,巴西7.6万吨,朝鲜3万吨,加拿大2.5万吨。美国没有开采自然石墨,但2009年共生产了11.8万吨合成石墨,估计总值9.98亿美元。[81]
钻石
[编辑]全球的钻石生产由少数大型企业控制,而钻石矿藏也只分布在地球的少数地区。
钻石矿石中只有极小部分是钻石。在最初压碎矿石时须避免损伤大块钻石,压碎后再以密度分开各种粒子。今天,人们利用X射线荧光光谱仪能够预先找到钻石含量较高的部分,接着的分类过程则由人工进行。在X光科技普及之前,人们用涂上油脂的运输带提取钻石。钻石比矿石中其他的矿物更容易粘在油脂上。[82]
历史上只有南印度出产钻石。[83]自公元前9世纪左右至[84]公元18世纪中叶,印度都是世界唯一的钻石产国。18世纪末,印度的矿藏已经衰减了许多,因此巴西1725年发现钻石后,成为了印度以外的首个钻石产地。[85]
1870年代人们发现了南非的钻石矿场,才开始了对主要矿藏(金伯利岩及钾镁煌斑岩)的开采。产量不断提高,截至2007年一共已有45亿卡拉钻石从当地开采出来。[86]钻石在美国主要分布在阿肯色州、科罗拉多州和蒙大拿州。[87][88]
今天经济效益最高的钻石产国有俄罗斯、博茨瓦纳、澳洲及刚果共和国。[89]俄罗斯的钻石产量为全球的五分之一。澳洲拥有钻石含量最高的矿藏,其年产量在1990年代达到4200万吨的顶峰。[87]其他的商业钻石矿场位于加拿大加拿大、俄罗斯西伯利亚(大部分在雅库特地区)、巴西以及澳洲北部和西部。
根据贝恩公司的报告,全球2018年钻石产量为1.47亿克拉,预计2019年产量为1.42亿克拉。[90]
应用
[编辑]





所有生物都依赖碳。如果没有碳,我们所知的生物形态都不可能存在(见假定性生物化学)。除了作食物和木材以外,碳的最大用途是在化石燃料上(以碳氢化合物的形式),如天然气和石油等。石油化学工业利用炼油厂把原油蒸馏成汽油和柴油。纤维素是一种植物制造的碳聚合物,出现在棉花和麻中。植物中的纤维素主要有支撑结构的作用。动物来源的碳聚合物有羊毛、羊绒和丝绸。塑料是人工合成的碳聚合物,一般在分子链中含有固定间隔的氧和氮原子。塑料的制造原料都可以从石油加工而成。
碳及其化合物的应用非常广泛。碳可以和铁形成合金,亦即钢。石墨与粘土混合后可制成铅笔芯,用于书写和绘画。石墨还能用作润滑剂、颜料、玻璃生产过程中的铸模材料、干电池中或电镀和电铸过程中的电极、电动机中的碳刷以及核反应堆中的中子减速剂等等。
木炭可用于绘画、烧烤、炼铁等等。木材、煤炭和石油都可用作燃料,用以发电或保暖。高质量钻石被用作首饰,而工业用钻石则可在金属或石头上进行钻孔、切割和磨光。化石燃料中的碳氢化合物能加工成塑料。聚酯纤维裂解后形成的碳纤维可以为塑料加固,产生轻盈的复合材料。碳纤维的制造原料为经拉伸过的聚丙烯腈(PAN)以及其他有机物质,其最终的晶体结构和力学属性取决于初始原料和制作工序。由PAN做成的碳纤维结构与细长的石墨丝相似,而经过热处理后,结构就会变成连续的一张薄片。这种纤维的拉伸比强度比钢还要高。[91]
炭黑的应用包括:黑色颜料、印刷墨水、艺术油墨和水彩、碳式复写纸、汽车油漆、墨和激光打印机碳粉。炭黑还可以用作橡胶和塑料的填充剂。活性炭可吸附、过滤物质,其应用范围包括防毒面具、水净化、厨房吸油烟机等,也可从消化系统中吸收毒物或气体作医学治疗。碳在高温下可以进行还原反应,如焦炭可将铁矿石转化为铁金属。钢与碳粉末一起加热后,可以达到表面硬化的作用。碳化硅、碳化钨、碳化硼和碳化钛都是超硬材料,在切割和碾磨时被用作磨料。几乎所有衣料都由碳化合物组成,如人造纺织品和皮革等。不同形式的碳是有希望的催化剂或催化剂载体[92][93]和电极材料[94][95][96]。
钻石
[编辑]钻石工业可基本分为宝石级和工业级钻石的生产和加工,两种市场的运作方式截然不同。
宝石级钻石交易市场巨大。但与金、铂等贵金属不同,钻石宝石的交易并不像日用品:其利润幅度很高,二手市场也不大。
工业用钻石市场主要注重钻石的硬度和热导率,而几乎忽略钻石的清澈度和颜色。因此开采出来的钻石中,有80%(即1亿卡拉、20吨)无法用作宝石,需要转到工业用途上。[97]1950年人工钻石被发明之后,马上就有了工业用途,年产量共有30亿卡拉(600吨)。[98]钻石在工业中主要被用于切割、钻孔、碾磨和磨光等,一般大小不需要太大。大部分宝石级钻石都可以用在工业上。钻石可以镶嵌在钻头或锯子上,或磨成粉末后进行碾磨和磨光。[99]在专门用途上,钻石可以作高压实验的器材(如钻石对顶砧)、高效轴承以及特殊窗户等。[100][101]在人工钻石生产技术的发展下,更多应用将在未来实现,如作为集成电路中的半导体或电子产品中的散热片等。[102]
安全
[编辑]纯碳对人类的毒性很低,甚至可以以石墨或木炭的形式直接安全进食。碳可以抵抗化学侵蚀,包括消化道中的酸。因此当进入人体组织后,碳会长时间存留。炭黑有可能是第一种被用作纹身的颜料。冰人奥茨的身上有碳刺青,一直保留到他死后5200年后的今天。[103]然而,大量吸入煤灰或煤烟却会刺激肺部,并造成煤工尘肺等阻塞性肺病。作磨料用的钻石粉末在进食或吸入后同样会造成危险。柴油引擎排烟中含有碳微粒,这些微粒会在肺部积聚。[104]如果进入身体的含碳物质还有其他的杂质,如有机化合物和重金属等,就有可能会对身体造成额外的伤害。
碳对大部分地球生物来说毒性都很低,但对某些生物却有毒。比如,碳纳米微尘对果蝇属是有毒的。[105]
碳在高温下能在空气中剧烈燃烧,如温斯乔火灾就是因加热的石墨造成的。大量煤炭在无氧状态下经过数亿年后,首次被挖出时,可能会在接触到空气后自燃。
碳的众多化合物中,有着多种剧毒,如河豚毒素、蓖麻毒蛋白、氰化物()和一氧化碳。
碳与各元素键合
[编辑]参见
[编辑]参考文献
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ History of Carbon and Carbon Materials - Center for Applied Energy Research - University of Kentucky. Caer.uky.edu. [2008-09-12]. (原始内容存档于2012-11-01).
- ^ 3.0 3.1 Senese, Fred. Who discovered carbon?. Frostburg State University. 2007-09-09 [2007-11-24]. (原始内容存档于2007-12-07).
- ^ Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 5.0 5.1 Haaland, D. Graphite-liquid-vapor triple point pressure and the density of liquid carbon. Carbon. 1976, 14 (6): 357. doi:10.1016/0008-6223(76)90010-5.
- ^ 6.0 6.1 Savvatimskiy, A. Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003). Carbon. 2005, 43 (6): 1115. doi:10.1016/j.carbon.2004.12.027.
- ^ Fourier Transform Spectroscopy of the System of CP (PDF). [2007-12-06]. (原始内容 (PDF)存档于2008-02-16).
- ^ Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical (PDF). [2007-12-06]. (原始内容 (PDF)存档于2008-02-16).
- ^ Carbon: Binary compounds. [2007-12-06]. (原始内容存档于2007-11-25).
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ 11.0 11.1 11.2 11.3 11.4 Properties of diamond (页面存档备份,存于互联网档案馆), Ioffe Institute Database
- ^ 12.0 12.1 12.2 Carbon – Naturally occurring isotopes. WebElements Periodic Table. [2008-10-09]. (原始内容存档于2008-09-08).
- ^ History of Carbon. [2013-01-10]. (原始内容存档于2012-11-01).
- ^ 14.0 14.1 World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE). [2008-10-09]. (原始内容存档于2008-10-05).
- ^ 15.0 15.1 Chemistry Operations. Carbon. Los Alamos National Laboratory. 2003-12-15 [2008-10-09]. (原始内容存档于2008-09-13).
- ^ Biological Abundance of Elements. The Internet Encyclopedia of Science. [2008-10-09]. (原始内容存档于2012-02-04).
- ^ Greenville Whittaker, A. The controversial carbon solid−liquid−vapour triple point. Nature. 1978, 276 (5689): 695–696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0.
- ^ Zazula, J. M. On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam (PDF). CERN. 1997 [2009-06-06]. (原始内容存档 (PDF)于2009-03-25).
- ^ Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene. Science. 2008, 321 (5887): 385–8. Bibcode:2008Sci...321..385L. PMID 18635798. doi:10.1126/science.1157996. 简明摘要.
- ^ Sanderson, Bill. Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator. nypost.com. 2008-08-25 [2008-10-09]. (原始内容存档于2008-09-06).
- ^ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi. Materials: Ultrahard polycrystalline diamond from graphite. Nature. 2003, 421 (6923): 599–600. PMID 12571587. doi:10.1038/421599b.
- ^ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny. Superlubricity of Graphite (PDF). Physical Review Letters. 2004, 92 (12) [2013-07-29]. doi:10.1103/PhysRevLett.92.126101. (原始内容存档 (PDF)于2013-12-24).
- ^ Collins, A.T. The Optical and Electronic Properties of Semiconducting Diamond. Philosophical Transactions of the Royal Society A. 1993, 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017.
- ^ Deprez, N.; McLachan, D. S. The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction. Journal of Physics D: Applied Physics (Institute of Physics). 1988, 21 (1): 101. Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015.
- ^ Delhaes, P. Graphite and Precursors. CRC Press. 2001. ISBN 90-5699-228-7.
- ^ 26.0 26.1 26.2 Unwin, Peter. Fullerenes(An Overview). [2007-12-08]. (原始内容存档于2007-12-01).
- ^ 27.0 27.1 Ebbesen, T. W. (编). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. 1997. ISBN 0-8493-9602-6.
- ^ 28.0 28.1 Dresselhaus, M. S.; Dresselhaus, G.; Avouris, Ph. (编). Carbon nanotubes: synthesis, structures, properties and applications. Topics in Applied Physics (Berlin: Springer). 2001, 80. ISBN 3-540-41086-4.
- ^ 29.0 29.1 Nasibulin, Albert G.; Pikhitsa, P.V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A.V.; Anisimov, A. S.; Queipo, P.; Moisala, A.; et al. A novel hybrid carbon material. Nature Nanotechnology. 2007, 2 (3): 156–161. Bibcode:2007NatNa...2..156N. PMID 18654245. doi:10.1038/nnano.2007.37.
- ^ Nasibulin, A; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. Investigations of NanoBud formation. Chemical Physics Letters. 2007, 446: 109–114. Bibcode:2007CPL...446..109N. doi:10.1016/j.cplett.2007.08.050.
- ^ Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong. Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2 over nickel catalyst. Applied Catalysis A. 2004, 274: 1–8. doi:10.1016/j.apcata.2004.04.008.
- ^ 32.0 32.1 Clifford, Frondel; Marvin, Ursula B. Lonsdaleite, a new hexagonal polymorph of diamond. Nature. 1967, 214 (5088): 587–589. Bibcode:1967Natur.214..587F. doi:10.1038/214587a0.
- ^ 33.0 33.1 33.2 Harris, PJF. Fullerene-related structure of commercial glassy carbons (PDF). Philosophical Magazine. 2004, 84 (29): 3159–3167. Bibcode:2004PMag...84.3159H. doi:10.1080/14786430410001720363. (原始内容 (PDF)存档于2012-03-19).
- ^ Rode, A. V.; Hyde, S. T.; Gamaly, E. G.; Elliman, R. G.; McKenzie, D. R.; Bulcock, S. Structural analysis of a carbon foam formed by high pulse-rate laser ablation. Applied Physics A-Materials Science & Processing. 1999, 69 (7): S755–S758. doi:10.1007/s003390051522.
- ^ 35.0 35.1 35.2 Heimann, Robert Bertram; Evsyukov, Sergey E. and Kavan, Ladislav. Carbyne and carbynoid structures. Springer. 1999-02-28: 1– [2011-06-06]. ISBN 978-0-7923-5323-2. (原始内容存档于2012-11-23).
- ^ Jenkins, Edgar. The polymorphism of elements and compounds. Taylor & Francis. 1973: 30 [2011-05-01]. ISBN 0-423-87500-0. (原始内容存档于2012-11-23).
- ^ Schewe, Phil and Stein, Ben. Carbon Nanofoam is the World's First Pure Carbon Magnet. Physics News Update. 2004-03-26, 678 (1) [2013-07-29]. (原始内容存档于2012-03-07).
- ^ Itzhaki, Lior; Altus, Eli; Basch, Harold; Hoz, Shmaryahu. Harder than Diamond: Determining the Cro]tional Area and Young's Modulus of Molecular Rods. Angew. Chem. Int. Ed. 2005, 44 (45): 7432–5. PMID 16240306. doi:10.1002/ange.200502448.
- ^ Mark, Kathleen. Meteorite Craters. University of Arizona Press. 1987. ISBN 0-8165-0902-6.
- ^ "Wonderfuel: Welcome to the age of unconventional gas" (页面存档备份,存于互联网档案馆) by Helen Knight, New Scientist, 12 June 2010, pp. 44–7.
- ^ Ocean methane stocks 'overstated' (页面存档备份,存于互联网档案馆), BBC, 17 Feb. 2004.
- ^ "Ice on fire: The next fossil fuel" (页面存档备份,存于互联网档案馆) by Fred Pearce, New Scientist, 27 June 2009, pp. 30-33.
- ^ Calculated from file global.1751_2008.csv in [1] (页面存档备份,存于互联网档案馆) from the Carbon Dioxide Information Analysis Center.
- ^ Kasting, James. The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning. Consequences: the Nature and Implication of Environmental Change. 1998, 4 (1) [2013-07-29]. (原始内容存档于2008-10-24).
- ^ Carbon-14 formation. [2013-07-29]. (原始内容存档于2015-08-01).
- ^ Gannes, Leonard Z.; Del Rio, Carlos Martı́nez; Koch, Paul. Natural Abundance Variations in Stable Isotopes and their Potential Uses in Animal Physiological Ecology. Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology. 1998, 119 (3): 725–737. doi:10.1016/S1095-6433(98)01016-2.
- ^ Official SI Unit definitions. [2007-12-21]. (原始内容存档于2007-10-14).
- ^ Brown, Tom. Carbon Goes Full Circle in the Amazon. Lawrence Livermore National Laboratory. 2006-03-01 [2007-11-25]. (原始内容存档于2008-09-22).
- ^ Bowman, S. Interpreting the past: Radiocarbon dating. British Museum Press. 1990. ISBN 0-7141-2047-2.
- ^ Libby, W. F. Radiocarbon dating. Chicago University Press and references therein. 1952.
- ^ Westgren, A. The Nobel Prize in Chemistry 1960. Nobel Foundation. 1960 [2007-11-25]. (原始内容存档于2007-10-25).
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. The NUBASE2020 evaluation of nuclear properties (PDF). Chinese Physics C. 2021, 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Watson, A. Beaming Into the Dark Corners of the Nuclear Kitchen. Science. 1999, 286 (5437): 28–31 [2013-07-29]. doi:10.1126/science.286.5437.28. (原始内容存档于2020-06-12).
- ^ Audi, G; Bersillon, O.; Blachot, J.; Wapstra, A.H. The Nubase evaluation of nuclear and decay properties (PDF). Nuclear Physics A. 1997, 624: 1. Bibcode:1997NuPhA.624....1A. doi:10.1016/S0375-9474(97)00482-X. (原始内容 (PDF)存档于2011-09-28).
- ^ Ostlie, D.A. and Carroll, B.W. An Introduction to Modern Stellar Astrophysics. Addison Wesley, San Francisco. 2007. ISBN 0-8053-0348-0.
- ^ Whittet, D. C. B. Dust in the Galactic Environment. CRC Press. 2003: 45–46. ISBN 0-7503-0624-6.
- ^ Pikelʹner, Solomon Borisovich. Star formation. Springer. 1977: 38– [2011-06-06]. ISBN 978-90-277-0796-3. (原始内容存档于2012-11-23).
- ^ Falkowski, P; Scholes, RJ; Boyle, E; Canadell, J; Canfield, D; Elser, J; Gruber, N; Hibbard, K; et al. The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System. Science. 2000, 290 (5490): 291–296. Bibcode:2000Sci...290..291F. PMID 11030643. doi:10.1126/science.290.5490.291.
- ^ Smith, T. M.; Cramer, W. P.; Dixon, R. K.; Leemans, R.; Neilson, R. P.; Solomon, A. M. The global terrestrial carbon cycle. Water, Air, & Soil Pollution. 1993, 70: 19–37. doi:10.1007/BF01104986.
- ^ Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali. The prebiological paleoatmosphere: stability and composition. Origins of Life and Evolution of Biospheres. 1982, 12 (3): 245–259. Bibcode:1982OrLi...12..245L. doi:10.1007/BF00926894.
- ^ Loerting, T.; et al. On the Surprising Kinetic Stability of Carbonic Acid. Angew. Chem. Int. Ed. 2001, 39 (5): 891–895. PMID 10760883. doi:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E.
- ^ Haldane J. The action of carbonic oxide on man. Journal of Physiology. 1895, 18 (5–6): 430–462. PMC 1514663
 . PMID 16992272.
. PMID 16992272.
- ^ Gorman, D.; Drewry, A.; Huang, Y. L.; Sames, C. The clinical toxicology of carbon monoxide. Toxicology. 2003, 187 (1): 25–38. PMID 12679050. doi:10.1016/S0300-483X(03)00005-2.
- ^ Compounds of carbon: carbon suboxide. [2007-12-03]. (原始内容存档于2007-12-07).
- ^ Bayes, K. Photolysis of Carbon Suboxide. Journal of the American Chemical Society. 1961, 83 (17): 3712–3713. doi:10.1021/ja01478a033.
- ^ Anderson D. J.; Rosenfeld, R. N. Photodissociation of Carbon Suboxide. Journal of Chemical Physics. 1991, 94 (12): 7852–7867. Bibcode:1991JChPh..94.7857A. doi:10.1063/1.460121.
- ^ Sabin, J. R.; Kim, H. A theoretical study of the structure and properties of carbon trioxide. Chemical Physics Letters. 1971, 11 (5): 593–597. Bibcode:1971CPL....11..593S. doi:10.1016/0009-2614(71)87010-0.
- ^ Moll N. G., Clutter D. R., Thompson W. E. Carbon Trioxide: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2. Journal of Chemical Physics. 1966, 45 (12): 4469–4481. Bibcode:1966JChPh..45.4469M. doi:10.1063/1.1727526.
- ^ 69.0 69.1 Fatiadi, Alexander J.; Isbell, Horace S.; Sager, William F. Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol) (PDF). Journal of Research of the National Bureau of Standards A: Physics and Chemistry. 1963, 67A (2): 153–162. doi:10.6028/jres.067A.015. (原始内容 (PDF)存档于2009年3月25日).
- ^ Pauling, L. The Nature of the Chemical Bond 3rd. Ithaca, NY: Cornell University Press. 1960: 93. ISBN 0-8014-0333-2.
- ^ Wright, David. Translating Science: The Transmission of Western Chemistry into Late Imperial China, 1840–1900. 2000. ISBN 978-9004117761.
- ^ Shorter Oxford English Dictionary, Oxford University Press
- ^ Chinese made first use of diamond. BBC News. 2005-05-17 [2007-03-21]. (原始内容存档于2007-03-20).
- ^ van der Krogt, Peter. Carbonium/Carbon at Elementymology & Elements Multidict. [2010-01-06]. (原始内容存档于2010-01-23).
- ^ Ferchault de Réaumur, R-A. L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (English translation from 1956). Paris, Chicago. 1722.
- ^ Carbon. Canada Connects. [2010-12-07]. (原始内容存档于2010-10-27).
- ^ Senese, Fred. Who discovered carbon?. Frostburg State University. [2007-11-24]. (原始内容存档于2007-12-07).
- ^ Giolitti, Federico. The Cementation of Iron and Steel. McGraw-Hill Book Company, inc. 1914.
- ^ Kroto, H. W.; Heath, J. R.; O'Brien, S. C.; Curl, R. F.; Smalley, R. E. C60: Buckminsterfullerene. Nature. 1985, 318 (6042): 162–163. Bibcode:1985Natur.318..162K. doi:10.1038/318162a0.
- ^ The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes". [2007-12-21]. (原始内容存档于2013-06-22).
- ^ 81.0 81.1 81.2 USGS Minerals Yearbook: Graphite, 2009 (页面存档备份,存于互联网档案馆) and Graphite: Mineral Commodity Summaries 2011
- ^ Harlow, G. E. The nature of diamonds. Cambridge University Press. 1998: 223. ISBN 0-521-62935-7.
- ^ Catelle, W.R. The Diamond. John Lane Company. 1911. Page 159 discussion on Alluvial diamonds in India and elsewhere as well as earliest finds
- ^ Ball, V. Diamonds, Gold and Coal of India. London, Truebner & Co. 1881. Ball was a Geologist in British service. Chapter I, Page 1
- ^ Hershey, J. W. The Book Of Diamonds: Their Curious Lore, Properties, Tests And Synthetic Manufacture. Kessinger Pub Co. 1940: 28. ISBN 1-4179-7715-9.
- ^ Janse, A. J. A. Global Rough Diamond Production Since 1870. Gems and Gemology (GIA). 2007, XLIII (Summer 2007): 98–119. doi:10.5741/GEMS.43.2.98.
- ^ 87.0 87.1 Lorenz, V. Argyle in Western Australia: The world's richest diamantiferous pipe; its past and future. Gemmologie, Zeitschrift der Deutschen Gemmologischen Gesellschaft (DGemG). 2007, 56 (1/2): 35–40.
- ^ Microscopic diamond found in Montana. The Montana Standard. 2004-10-17 [2008-10-10]. (原始内容存档于2005-01-21).
- ^ Marshall, Stephen; Shore, Josh. The Diamond Life. Guerrilla News Network. 2004-10-22 [2008-10-10]. (原始内容存档于2008-06-09).
- ^ 存档副本 (PDF). [2020-08-20]. (原始内容存档 (PDF)于2020-08-20).
- ^ Cantwell, W. J.; Morton, J. The impact resistance of composite materials – a review. Composites. 1991, 22 (5): 347–62. doi:10.1016/0010-4361(91)90549-V.
- ^ Prekob, Ádám; Hajdu, Viktória; Muránszky, Gábor; Kocserha, István; Fiser, Béla; Viskolcz, Béla; Vanyorek, László. Application of carbonized ion exchange resin beads as catalyst support for gas phase hydrogenation processes. Reaction Kinetics, Mechanisms and Catalysis (Springer Science and Business Media LLC). 2019-11-02, 129 (1): 85–94. ISSN 1878-5190. doi:10.1007/s11144-019-01694-7.
- ^ Sikora, Emőke; Kiss, Adrienn; H. Göndör, Zsuzsa; Pekker, Péter; Kristály, Ferenc; Szőri, Milán; Rágyanszki, Anita; Viskolcz, Béla; Fiser, Béla; Vanyorek, László. Fine-tuning the catalytic activity by applying nitrogen-doped carbon nanotubes as catalyst supports for the hydrogenation of olefins. Reaction Kinetics, Mechanisms and Catalysis (Springer Science and Business Media LLC). 2019-12-14, 129 (1): 95–106. ISSN 1878-5190. doi:10.1007/s11144-019-01705-7.
- ^ Pangotra, Dhananjai; Csepei, Lénárd-István; Roth, Arne; Ponce de León, Carlos; Sieber, Volker; Vieira, Luciana. Anodic production of hydrogen peroxide using commercial carbon materials. Applied Catalysis B: Environmental (Elsevier BV). 2022, 303: 120848. ISSN 0926-3373. doi:10.1016/j.apcatb.2021.120848.
- ^ Perry, Samuel C.; Pangotra, Dhananjai; Vieira, Luciana; Csepei, Lénárd-István; Sieber, Volker; Wang, Ling; Ponce de León, Carlos; Walsh, Frank C. Electrochemical synthesis of hydrogen peroxide from water and oxygen. Nature Reviews Chemistry (Springer Science and Business Media LLC). 2019-06-19, 3 (7): 442–458. ISSN 2397-3358. doi:10.1038/s41570-019-0110-6.
- ^ Duan, Weijian; Li, Ge; Lei, Zhenchao; Zhu, Tonghe; Xue, Yuzhou; Wei, Chaohai; Feng, Chunhua. Highly active and durable carbon electrocatalyst for nitrate reduction reaction. Water Research (Elsevier BV). 2019, 161: 126–135. ISSN 0043-1354. doi:10.1016/j.watres.2019.05.104.
- ^ Holtzapffel, Ch. Turning And Mechanical Manipulation. Charles Holtzapffel. 1856 [2013-07-29]. (原始内容存档于2013-06-20). Internet Archive (页面存档备份,存于互联网档案馆)
- ^ Industrial Diamonds Statistics and Information. United States Geological Survey. [2009-05-05]. (原始内容存档于2009-05-06).
- ^ Coelho, R. T.; Yamada, S.; Aspinwall, D.K.; Wise, M.L.H. The application of polycrystalline diamond (PCD) tool materials when drilling and reaming aluminum-based alloys including MMC. International journal of machine tools & manufacture. 1995, 35 (5): 761. doi:10.1016/0890-6955(95)93044-7.
- ^ Harris, D. C. Materials for infrared windows and domes: properties and performance. SPIE Press. 1999: 303–334. ISBN 0-8194-3482-5.
- ^ Nusinovich, G. S. Introduction to the physics of gyrotrons. JHU Press. 2004: 229. ISBN 0-8018-7921-3.
- ^ Sakamoto, M.; Endriz, J. G.; Scifres, D. R. 120 W CW output power from monolithic AlGaAs (800 nm) laser diode array mounted on diamond heatsink. Electronics Letters. 1992, 28 (2): 197–199. doi:10.1049/el:19920123.
- ^ Dorfer, Leopold; Moser, M; Spindler, K; Bahr, F; Egarter-Vigl, E; Dohr, G. 5200-year old acupuncture in Central Europe?. Science. 1998, 282 (5387): 242–243. Bibcode:1998Sci...282..239D. PMID 9841386. doi:10.1126/science.282.5387.239f.
- ^ Donaldson, K; Stone, V; Clouter, A; Renwick, L; MacNee, W. Ultrafine particles. Occupational and Environmental Medicine. 2001, 58 (3): 211–216 [2013-07-29]. PMC 1740105
 . PMID 11171936. doi:10.1136/oem.58.3.211. (原始内容存档于2009-05-01).
. PMID 11171936. doi:10.1136/oem.58.3.211. (原始内容存档于2009-05-01).
- ^ Carbon Nanoparticles Toxic To Adult Fruit Flies But Benign To Young (页面存档备份,存于互联网档案馆) ScienceDaily (Aug. 17, 2009)
外部链接
[编辑]- 元素碳在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 碳(英文)
- 元素碳在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素碳在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 碳(英文)
- Carbon (页面存档备份,存于互联网档案馆) at The Periodic Table of Videos(诺丁汉大学)
- 大英百科全书:碳 (页面存档备份,存于互联网档案馆)
- 碳在电化学中的应用
































