肉桂酸
外观
(重定向自桂皮酸)
| 肉桂酸 | |
|---|---|

| |
| |
| IUPAC名 (E)-3-苯基-2-丙烯酸 (E)-3-phenylprop-2-enoic acid | |
| 别名 | 桂皮酸 |
| 识别 | |
| CAS号 | 140-10-3 |
| PubChem | 444539 |
| ChemSpider | 392447 |
| SMILES |
|
| InChI |
|
| InChIKey | WBYWAXJHAXSJNI-VOTSOKGWBT |
| ChEBI | 35697 |
| KEGG | C00423 |
| IUPHAR配体 | 3203 |
| 性质 | |
| 化学式 | C6H5CHCHCOOH |
| 摩尔质量 | 148.17 g·mol⁻¹ |
| 外观 | 白色单斜晶体 |
| 气味 | 蜂蜜[1] |
| 密度 | 1.2475 g/cm3[2] |
| 熔点 | 133 °C[2] |
| 沸点 | 300 °C[2] |
| 溶解性(水) | 0.5 g/L[2] |
| pKa | 4.44 |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R36 |
| 安全术语 | S:S25 |
| 闪点 | > 100 °C[2] |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
肉桂酸(英语:Cinnamic acid,IUPAC名:(E)-3-苯基-2-丙烯酸),分子式为C6H5CHCHCOOH。是微溶于水的白色结晶化合物。归类为不饱和羧酸,它天然存在于许多植物。它易溶于许多有机溶剂。[3]它同时存在顺式和反式异构体,虽然后者是较常见。[4]
存在和生产
[编辑]生物合成
[编辑]肉桂酸是包括lignol(木质素和木质纤维素的前体)、黄酮类化合物、异黄酮类、香豆素、噢哢、芪类化合物、儿茶素和苯丙烯类在内的无数天然产物生物合成的核心中间体。它的生物合成涉及苯丙氨酸氨裂合酶 (PAL) 作用苯丙氨酸。[5]
自然来源
[编辑]它是从肉桂油,或香脂如苏合香树中获得。[3]它还在乳木果油中发现。肉桂酸具有蜜样气味,[1]及其挥发性更强的乙酯(肉桂酸乙酯)是肉桂精油中的风味成分,其中相关的肉桂醛是主要成分。
制备
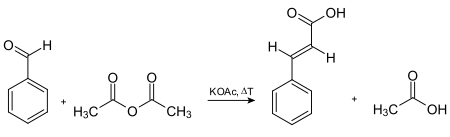
[编辑]肉桂酸最早是通过乙酰氯和苯甲醛的碱催化缩合合成,然后水解产生的酰氯。[4]1890年,Rainer Ludwig Claisen描述了通过乙酸乙酯与苯甲醛在钠作为碱的存在下反应,形成肉桂酸乙酯。[6]另一种制备肉桂酸的方法是通过克脑文盖尔缩合反应。[7]在弱碱存在下,反应物是苯甲醛和丙二酸,然后酸催化脱羧而成。它也可通过肉桂醛的氧化、二氯化苄和乙酸钠的缩合(随后酸水解)和珀金反应制备。最早的商业肉桂酸制备途径涉及珀金反应,反应见下:[4]
代谢
[编辑]肉桂酸是由肉桂醛自氧化而成的,然后在肝脏中代谢成苯甲酸钠。[9]
用途
[编辑]肉桂酸是用在香料剂,合成靛蓝,和某些药物上。肉桂酸的一个主要用途是制造用于香水业的肉桂酸甲酯、肉桂酸乙酯和肉桂酸苄酯。[3]肉桂酸是甜味剂阿斯巴甜的前体,经由酶催化的胺化至苯丙氨酸。[4]
参考资料
[编辑]- ^ 1.0 1.1 Cinnamic acid. flavornet.org. [2021-08-30]. (原始内容存档于2021-08-30). 引用错误:带有name属性“Cinnamic acid”的
<ref>标签用不同内容定义了多次 - ^ 2.0 2.1 2.2 2.3 2.4 Record in the GESTIS Substance Database from the IFA
- ^ 3.0 3.1 3.2 Budavari, Susan (编), The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals 12th, Merck, 1996, ISBN 0911910123
- ^ 4.0 4.1 4.2 4.3 Garbe, Dorothea, Cinnamic Acid, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a07_099
- ^ Vogt, T. Phenylpropanoid Biosynthesis. Molecular Plant. 2010, 3 (1): 2–20. PMID 20035037. doi:10.1093/mp/ssp106
 .
.
- ^ Claisen, L. Zur Darstellung der Zimmtsäure und ihrer Homologen [On the preparation of cinnamic acid and its homologues]. Berichte der Deutschen Chemischen Gesellschaft. 1890, 23: 976–978. doi:10.1002/cber.189002301156.
- ^ Tieze, L. Reactions and Synthesis in the Organic Chemistry Laboratory. Mill Vall, CA. 1988: 1988.
- ^ F. K. Thayer. m-Nitrocinnamic Acid. Organic Syntheses. 1925, 5: 83. doi:10.15227/orgsyn.005.0083.
- ^ Jana A, Modi KK, Roy A, Anderson JA, van Breemen RB, Pahan K. Up-regulation of neurotrophic factors by cinnamon and its metabolite sodium benzoate: therapeutic implications for neurodegenerative disorders. Journal of Neuroimmune Pharmacology. June 2013, 8 (3): 739–55. PMC 3663914
 . PMID 23475543. doi:10.1007/s11481-013-9447-7.
. PMID 23475543. doi:10.1007/s11481-013-9447-7.