凝血

凝血(coagulation,clotting)即血液凝固,是血液由液体状态转变为不流动的凝胶状态的过程,是生理性止血的重要环节。凝血的实质就是血浆中的可溶性纤维蛋白原变成不可溶的纤维蛋白的过程。
抗凝(anticoagulation)或抗凝作用,是对抗凝血的机制或医疗,即除去或抑制血液中的某些凝血因子,阻止血液凝固的物理或化学方法,包括抗凝剂的使用。
凝血系统的作用包括:(1) 维持血管内血液处于流体状态且没有凝块;(2) 在血管损伤时,于血管内快速、局部诱导凝血形成(血栓)。[1]
凝血因子(coagulation factor,clotting factor)是血浆与组织中直接参与血液凝固过程的物质(酶原或辅因子)。
凝血因子
[编辑]凝血因子是参与血液凝固过程的各种蛋白质组分。它的生理作用是,在血管出血时被激活,和血小板粘连在一起并且补塞血管上的漏口。这个过程称为凝血。它们部分由肝生成。可以为香豆素所抑制。为统一命名,世界卫生组织按其被发现的先后次序用罗马数字编号,有凝血因子I,II,III,IV,V,VII,VIII,IX,X,XI,XII,XIII,XIII等,因子XIII以后被发现的凝血因子,经过多年验证,认为对于凝血功能,无决定性的影响,不再列入凝血因子的编号。因子VI事实上是活化的第五因子,已经取消因子VI的命名。
除两个新发现的凝血因子外,其余的凝血因子按发现的先后顺序,由国际凝血因子命名委员会(International Committee on the Nomenclature of Blood Clotting Factors)以罗马数字统一命名。活化后的凝血因子,在其名字的右下方以字母“a”标示。[2]
| 编号与/或名称 | 功能 | 相关遗传疾病 |
|---|---|---|
| Ⅰ(纤维蛋白原) | 形成凝块(纤维蛋白) | 先天性纤维蛋白原缺乏血症、家族性肾淀粉样变 |
| Ⅱ(凝血酶原) | 其活性形式(Ⅱa)激活Ⅰ、Ⅴ、Ⅹ、Ⅶ、Ⅷ、Ⅺ、XIII、蛋白C、血小板 | 凝血酶原G20210A、血栓形成倾向症 |
| Ⅲ(组织因子或组织促凝血酶原激酶) | Co-factor of VIIa (formerly known as factor III) | |
| Ⅳ(钙) | Required for coagulation factors to bind to phospholipid (formerly known as factor IV) | |
| Ⅴ(前加速素、易变因子) | Co-factor of X with which it forms the prothrombinase complex | Activated protein C resistance |
| VI | Unassigned – old name of Factor Va | |
| VII (stable factor, proconvertin) | Activates IX, X | congenital factor VII deficiency |
| VIII(抗血友病因子甲) | Co-factor of IX with which it forms the tenase complex | 甲型血友病 |
| IX (Antihemophilic factor B or Christmas factor) | Activates X: forms tenase complex with factor VIII | Haemophilia B |
| X (Stuart-Prower factor) | Activates II: forms prothrombinase complex with factor V | Congenital Factor X deficiency |
| XI (plasma thromboplastin antecedent) | Activates IX | Haemophilia C |
| XII (Hageman factor) | Activates factor XI, VII and prekallikrein | Hereditary angioedema type III |
| XIII (fibrin-stabilizing factor) | Crosslinks fibrin | Congenital Factor XIIIa/b deficiency |
| 类血友病因子 | Binds to VIII, mediates platelet adhesion | von Willebrand disease |
| 前激肽释放酶 (Fletcher factor) | Activates XII and prekallikrein; cleaves HMWK | Prekallikrein/Fletcher Factor deficiency |
| 高分子量激肽原 (HMWK) (Fitzgerald factor) | Supports reciprocal activation of XII, XI, and prekallikrein | Kininogen deficiency |
| 纤连蛋白 | Mediates cell adhesion | Glomerulopathy with fibronectin deposits |
| 抗凝血酶 III | Inhibits IIa, Xa, and other proteases | Antithrombin III deficiency |
| heparin cofactor II | Inhibits IIa, cofactor for heparin and dermatan sulfate ("minor antithrombin") | Heparin cofactor II deficiency |
| 蛋白C | Inactivates Va and VIIIa | Protein C deficiency |
| 蛋白S | Cofactor for activated protein C (APC, inactive when bound to C4b-binding protein) | Protein S deficiency |
| 蛋白Z | Mediates thrombin adhesion to phospholipids and stimulates degradation of factor X by ZPI | Protein Z deficiency |
| Protein Z-related protease inhibitor (ZPI) | Degrades factors X (in presence of protein Z) and XI (independently) | |
| 纤溶酶原 | Converts to plasmin, lyses fibrin and other proteins | Plasminogen deficiency, type I (ligneous conjunctivitis) |
| alpha 2-antiplasmin | Inhibits plasmin | Antiplasmin deficiency |
| 组织型纤溶酶原激活物 (tPA) | Activates plasminogen | Familial hyperfibrinolysis and thrombophilia |
| 尿激酶 | Activates plasminogen | Quebec platelet disorder |
| 纤溶酶原激活物抑制剂-1 (PAI1) | Inactivates tPA & urokinase (endothelial PAI) | Plasminogen activator inhibitor-1 deficiency |
| 纤溶酶原激活物抑制剂-2 (PAI2) | Inactivates tPA & urokinase (placental PAI) | |
| cancer procoagulant | Pathological factor X activator linked to thrombosis in cancer |
在人类中,因子XI缺乏可能与出血表型有关。 因子XI也可能参与人类血栓形成,因为这种蛋白质的缺乏与缺血性中风风险降低相关,但与心肌梗塞风险降低无关。[3]
主要凝血因子
[编辑]| 凝血因子序号 | 同义名称 | 化学本质 | 合成场所 | 血浆中浓度(mg/L) | 参与凝血途径 | 主要功能 |
|---|---|---|---|---|---|---|
| 凝血因子I | 纤维蛋白原 | 糖蛋白 | 肝脏 | 3000 | 共同途径 | 形成纤维蛋白凝胶 |
| 凝血因子II | 凝血素、凝血酶原 | 糖蛋白 | 肝脏 | 100 | 共同途径 | 丝氨酸蛋白酶催化纤维蛋白原转化为纤维蛋白 |
| 凝血因子III | 凝血酶原酶、组织因子 | 脂蛋白 | 组织内皮细胞 单核细胞 |
- | 外源途径 | 因子VII的辅因子 |
| 凝血因子IV | 钙因子、钙离子 | 钙离子(Ca2+) | - | 5 | 内、外及共同途径 | 多种因子的辅因子 |
| 凝血因子V | 前加速素、促凝血球蛋白原或易变因子 | 糖蛋白 | 肝脏 | 5~10 | 共同途径 | 因子X的辅因子 |
| 凝血因子VII | 血清凝血酶原转变加速素、转变加速因子前体、 促凝血酶原激酶原、辅助促凝血酶原激酶或SPAC |
糖蛋白 | 肝脏 | 2 | 外源途径 | 丝氨酸蛋白酶激活因子X |
| 凝血因子VIII | 抗血友病A球蛋白(AHG)、抗血友病球蛋白A(AHG A)、 抗血友病因子A(AHFA)、血小板辅助因子I、 血友病因子VIII或A |
糖蛋白 | 肝脏 | 0.1 | 内源途径 | 因子IX的辅因子、加速因子X的生成 |
| 凝血因子IX | 抗血友病B因子(PTC)、抗血友病球蛋白B(AHG B)、 抗血友病因子B(AHF B)、血友病因子IX或B |
糖蛋白 | 肝脏 | 5 | 内源途径 | 丝氨酸蛋白酶激活因子X |
| 凝血因子X | 自体凝血酶原C、Stuart Prower因子或 STUART(-PROWER)-F |
糖蛋白 | 肝脏 | 10 | 共同途径 | 丝氨酸蛋白酶激活因子II |
| 凝血因子XI | 抗血友病球蛋白C、抗丙种血友病因子或 ROSENTHAL因子 |
糖蛋白 | 肝脏 | 5 | 内源途径 | 丝氨酸蛋白酶激活因子IX |
| 凝血因子XII | 接触因子、表面因子或HAGEMAN因子 | 糖蛋白 | 肝脏 | 30 | 内源途径 | 丝氨酸蛋白酶激活因子IX及PK |
| 凝血因子XIII | 纤维蛋白稳定因子、血纤维稳定因子 | 糖蛋白 | 肝脏、血小板 | 25 | 共同途径 | 纤维蛋白交联稳定转谷氨酰酶 |
辅助凝血因子
[编辑]- FITZGERALD因子
- FLETCHER因子(激肽释放酶原)激肽释放酶原在精氨酸(371)-异亮氨酸(372)肽键断裂,转变为由重链和轻链组成的激肽释放酶,酶活性中心为轻链。激肽释放酶是激活因子XⅡ、XⅠ、VⅡ,使高相对分子质量激肽原转变成激肽,使纤溶酶原转变成纤溶酶。
- von-Willebrand-因子
被取消资格的凝血因子
[编辑]- 因子VI,促凝血球蛋白:其实是活化后的第五因子。
凝血机制
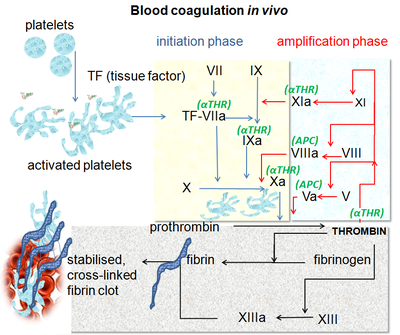
[编辑]血液凝固是一个复杂的过程,为了叙述方便,可以大致划分为三个阶段,分别是凝血酶原激活物形成(formation of prothrombin activator)、凝血酶原转化为凝血酶(conversion of prothrombin to thrombin)和纤维蛋白原转化为纤维蛋白(conversion of fibrinogen to fibrin)。凝血酶原激活物形成有两类不同的机制(内源途径和外源途径),这两套机制最后汇总于凝血酶形成和纤维蛋白形成,因此后两者也被称为共同途径(common pathway)。 由于出血是需要紧急处置的,因此,正常情况下,凝血过程是迅速的。为了做到这一点,凝血机制内部采用级联机制(cascade mechanism)逐级放大凝血信号,并有很多正反馈环节加强凝血过程。此外,凝血机制也和其它止血机制(尤其是血小板血栓形成机制)相互作用(cross talk),彼此加强和促进。 与此同时,为了防止正常情况下意外形成血栓,或者出血部位形成的血栓不受控制,机体还有抗凝机制和纤溶机制对抗凝血机制。
凝血酶原激活物形成
[编辑]传统上依据触发因素是否存在于血液内部,将本阶段的机制分为内源途径(intrinsic pathway)和外源途径(extrinsic pathway)。内源途径通常较慢,而外源途径则比较迅速。在实际的生理过程中,这两个途径常常交织在一起;而在病理情况下,似乎外源途径更重要。
内源途径
[编辑]触发血液凝结的内源途径也称为“接触途径”,此途径无需血液或血浆中的组织因子即可触发。 当血浆与某些类型的人造表面,例如玻璃试管、硅藻土等接触时,该途径便可触发。FXII的激活会在常用的诊断性血浆凝血试验(活化部分凝血活酶时间 ,aPTT)中启动凝血。 尽管接触激活在体外凝块中发挥重要作用,但似乎对体内止血没有贡献,因为缺乏FXI的小鼠和人类并没有出血倾向。在ECMO等治疗中,需要抗凝(例如柠檬酸盐或肝素)来维持体外回路的血流,因FXIIa 的产生会导致下游酶的裂解,但该过程中夫人这些抗凝剂都不会阻止接触激活,而是通过抑制下游凝血酶的活性产生作用。[2]
- 血液与人造表面的接触会导致FXII构象发生变化,从而产生少量活性FXII(fXIIa)。
- 激活FXII:异物表面或者胶原可以吸附FXII和高分子量激肽原(high-molecular-weight kininogen,HMW-K),并直接激活FXII;此外,血小板也被激活,继而释放磷脂和血小板因子3(platelet factor 3)。
- 激活FⅪ:HMW-K能与FⅪ结合,将FⅪ带到FⅫa附近,随后FⅪ被激活。HMW-K还能结合前激肽释放肽(prekallikrein,pre-K),pre-K能加速FⅫa对FⅪ的活化。
- 激活FⅨ:FⅪa可使FⅨ活化。此过程较缓慢,是内源途径的控速步骤。
- 激活FX:FⅨa在血小板磷脂、血小板因子3、钙离子的作用下,与FⅧa形成FⅨa-FⅧa复合物,该复合物可以活化FⅩ。
- 凝血酶原激活物形成:见下文。
外源途径
[编辑]- 组织因子释放:组织因子(TF)广泛存在于各种组织细胞中;而在生理情况下与血液接触的血细胞和血管内皮细胞均不表达。当血管受损后,血管内皮细胞屏障被破坏,其下方的组织就暴露出组织因子,启动外源途径。在脓毒症期间,TF在单核细胞上表达,但在某些区域(例如脾微血管系统)的内皮细胞也表达。[2]
- 游离FVIIa是一种非常弱的酶,但是TF:VIIa复合物是极有效的凝结激活剂。 TF:VIIa复合物一旦形成,即可通过有限的蛋白水解激活凝结级联中的两个下游底物:因子IX(FIX)转换为FIXa,FX转换为FXa。[2]
- 该途径启动的血小板激活不需要破坏内皮细胞,并且独立于冯维勒布兰德因子(vWF)和糖蛋白VI。[3]
- 激活FX:组织因子与血浆中的钙离子、因子VII(FVII)(或FⅦa,因子VII的酶活性形式)结合,形成TF-Ca2+-FVII/FVIIa复合物,此复合物激活因子 IX(FIX),从而启动蛋白水解级联反应,生成凝血酶。因子中游离硫醇氧化形成二硫键,产生一种构象,使组织因子-VIIa 因子复合物能够结合并激活 FX 。[3]
- 凝血酶原激活物形成。
凝血酶原激活物形成
[编辑]这是内源途径和外源途径均汇总于此。FXa在磷脂(由周围组织及血小板提供)的存在下,与钙离子和FⅤ形成FXa-Ca2+-FV复合物,此复合物就是凝血酶原激活物(又名凝血活酶),可将凝血酶原水解为凝血酶。凝血酶反过来可将FXa-Ca2+-FV复合物中的FV激活为FVa,形成FXa-Ca2+-FVa复合物,它激活凝血酶原的能力更强。凝血酶裂解血小板表面的蛋白酶激活受体(protease-activated receptor,Par),从而激活血小板并使其释放二磷酸腺苷 (ADP)、血清素和血栓素A。反过来这些激动剂又激活其他血小板,放大血栓形成的信号。[3]
正在形成的血栓会募集未受刺激的血小板,并且血栓内的激活仅发生在募集的血小板的一个亚组中。 其他的则与血栓保持松散的联系,但不会被激活,最终可能会脱离血栓。血栓形成是一个动态过程,其中一些血小板粘附在正在形成的血栓上,而另一些则与正在形成的血栓分离,并且循环中的剪切、流动、湍流和血小板数量极大地影响着血栓的结构。与受损血管壁结合的血小板的激活会导致 αIIbβ3发生构象转变,从而增加整合素与其配体、纤维蛋白原和vWF的附着。低剪切速率下,纤维蛋白原是主要配体,高剪切率则vWF起着重要作用。[3]
内皮被认为在流动的血液中充当屏障,将因子VIIa与组织因子的细胞来源分离,以防止在没有损伤的情况下开始凝血。[3]
共同途径
[编辑]凝血酶原转化为凝血酶
[编辑]在FXa-Ca2+-FV/FVa复合物作用下,凝血酶原转化为凝血酶。凝血酶激活凝血酶原的能力比FXa-Ca2+-FVa复合物还强,可形成一个强烈的正反馈环路。
凝血酶也是血小板的有效活化剂,进一步有助于形成保护性止血塞(正常止血)或血栓(凝血的病理激活)。[2]
纤维蛋白原转化为纤维蛋白
[编辑]凝血酶通过有限的蛋白水解有效地将一个纤维蛋白原分子释放四个小肽(两个A肽和两个B肽)形成纤维蛋白单体。纤维蛋白单体可自发地通过氢键形成纤维蛋白多聚体,并形成网状的纤维蛋白束(fibrin fiber),自发地组装成纤维蛋白凝块。[2]这种网状结构俘获了很多血细胞,其中包括血小板。血小板释放出的FXⅢ被凝血酶激活后,可催化纤维蛋白单体之间的共价交联反应。此外,血小板的收缩通过牵拉纤维蛋白束使血栓收缩,挤出多余的液体,被挤出的液体就成为血清(serum)。 血栓的收缩可使血栓进一步固实,同时也使血管的破口缩小。
另外,纤溶酶原被组织型纤溶酶原激活剂(tissue-type plasminogen activator,tPA)和尿激酶纤溶酶原激活剂(urokinase plasminogen activator,uPA)激活形成纤溶酶,在多个位点裂解纤维蛋白,释放出主要为D二聚体的纤维蛋白降解产物(fibrin degradation products,FDP)。 纤溶酶还可以通过诱导 FXIIIa 裂解来最大限度地减少纤维蛋白的交联[1]。
相关疾病
[编辑]血友病(Hemophilia)是一组遗传性因子VⅢ和IX基因缺乏、基因突变、基因缺失、基因插入等导致患者激活凝血酶原酶的功能发生障碍所引起的严重遗传性出血疾病,主要是先天性出血性疾病中最常见的疾病,男女均可患病,但男性患者居多。主要包括血友病A(甲型、因子VⅢ缺乏症)、血友病B(乙型、因子IX缺乏症)和因子XI缺乏症(曾称血友病丙型)。A型和B型血友病为性连锁(伴性)隐性遗传,遗传基因分别位于Xq28和Xq27。血友病发病率A:B为138:20。血友病的临床特点是:自发性或轻微外伤出血难止。血友病的治疗方法主要包括局部止血、替代疗法等。替代疗法中输血浆为轻型血友病患者的最佳选择,新兴疗法包括输注重组人凝血因子(注射用重组人凝血因子VIIa,诺其)治疗,这类疗法病菌污染可能性低,因此较安全,越来越多成为临床选择。

外部链接
[编辑]参考文献
[编辑]- ^ 1.0 1.1 Genga, Kelly R.; Russell, James A. Chapter 88 - Coagulation Abnormalities in Sepsis. Ronco, Claudio (编). Critical Care Nephrology (Third Edition). Philadelphia: Elsevier. 2019-01-01: 508–517.e3 [2023-10-19]. ISBN 978-0-323-44942-7. doi:10.1016/b978-0-323-44942-7.00088-1. (原始内容存档于2021-12-13).
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 Smith, Stephanie A.; Travers, Richard J.; Morrissey, James H. How it all starts: Initiation of the clotting cascade. Critical Reviews in Biochemistry and Molecular Biology. 2015-07-04, 50 (4) [2023-10-10]. ISSN 1040-9238. doi:10.3109/10409238.2015.1050550. (原始内容存档于2023-03-12) (英语).
- ^ 3.0 3.1 3.2 3.3 3.4 3.5 Furie, Bruce; Furie, Barbara C. Mechanisms of Thrombus Formation. New England Journal of Medicine. 2008-08-28, 359 (9). ISSN 0028-4793. doi:10.1056/NEJMra0801082 (英语).
- Arthur C. Guyton; John E. Hall. Textbook of medical physiology. Pennsylvania: Elsevier. 2006. ISBN 0-8089-2317-X.
- 姚泰; 罗自强. 生理学. 北京: 人民卫生出版社. 2001. ISBN 7-117-04070-X.
- 查锡良; 周春燕. 生物化学. 北京: 人民卫生出版社. 2008. ISBN 7-117-09688-8.
- 陆再英; 钟南山. 内科学. 北京: 人民卫生出版社. 2008. ISBN 978-7-117-09652-2.
