三氧化二磷
外观
(重定向自六氧化四磷)
| 三氧化二磷 | |
|---|---|
| |

| |

| |
| 别名 | 六氧化四磷 |
| 识别 | |
| CAS号 | 1314-24-5 |
| PubChem | 123290 |
| ChemSpider | 109897 |
| SMILES |
|
| InChI |
|
| InChIKey | VSAISIQCTGDGPU-UHFFFAOYAV |
| ChEBI | 37372 |
| 性质 | |
| 化学式 | P4O6 |
| 摩尔质量 | 109.946 g·mol⁻¹ |
| 外观 | 无色单斜晶体或液体 |
| 密度 | 2.13 g/cm3 |
| 熔点 | 23.8 °C |
| 沸点 | 173 °C |
| 溶解性(水) | 与水反应 |
| pKa | 9.2 |
| 结构 | |
| 偶极矩 | 0 |
| 危险性 | |
| NFPA 704 | |
| 相关物质 | |
| 其他阴离子 | 三硫化四磷 |
| 其他阳离子 | 三氧化二氮 三氧化二砷 三氧化二锑 |
| 相关化学品 | 五氧化二磷 亚磷酸 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
三氧化二磷(化学式:P4O6)是一种由氧和磷组成的化合物。它是一种白色蜡状有大蒜气味的极毒晶体,在室温下融化[1]。虽然它的正确名称应该是六氧化四磷,但以前一直以为分子结构是P2O3,因此三氧化二磷的名称一直沿用至今。
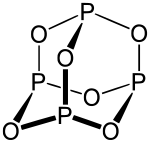
三氧化二磷为Td结构,其结构与金刚烷类似,可以看做是金刚烷中的四个叔碳被磷原子替代,而六个仲碳被氧原子替代。
制备
[编辑]三氧化二磷由白磷在有限的氧气中燃烧得到。该反应产率可达50%,产物中含少量白磷,可用汞弧灯照射将白磷转化为红磷,然后加热蒸出三氧化二磷而进行提纯。反应的副产物还有五氧化二磷和一氧化四磷。[1]
化学性质
[编辑]200-400°C时在密封管中减压加热三氧化二磷时,三氧化二磷分解为四氧化二磷和红磷:
- (红磷)
与热水的反应复杂且较为剧烈,生成红磷、磷化氢、亚磷酸和磷酸。[2]
与氯、溴单质反应生成三氯氧磷和三溴氧磷。与碘反应很慢,生成红色的产物。加压条件下二者在四氯化碳中反应,析出橘红色的四碘化二磷:[1]
P4O6和臭氧在 195 K 下反应,形成不稳定的 P4O18。[3]
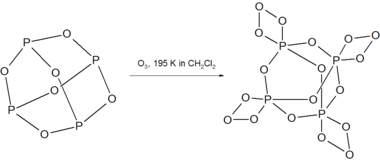
P4O18在238 K以上的溶液中分解,释放O2气体。干燥的P4O18分解时会爆炸。
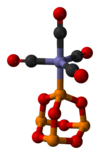
P4O6也可以作为配体(性质类似于亚磷酸酯),取代四羰基镍或五羰基铁中的羰基,形成一系列的配合物。以P4O6·Fe(CO)4为例,该配合物有如下图所示的结构,其中三氧化二磷是用一个磷原子与Fe配位(X射线单晶衍射数据)。[4]
参见
[编辑]参考资料
[编辑]- ^ 1.0 1.1 1.2 A. F. Holleman; Wiberg, Egon; Wiberg, Nils. Inorganic Chemistry. Boston: Academic Press. 2001. ISBN 0-12-352651-5.
- ^ 2.0 2.1 Ralf Steudel: Chemie der Nichtmetalle, Synthesen - Strukturen - Bindung - Verwendung, 4. Auflage, 2014 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-030439-8, S. 407–408, (abgerufen über De Gruyter Online).
- ^ .Catherine E. Housecroft; Alan G. Sharpe. Chapter 15: The group 15 elements. Inorganic Chemistry, 3rd Edition. Pearson. 2008: 473. ISBN 978-0-13-175553-6.
- ^ M. Jansen and J. Clade. Tetracarbonyl(tetraphosphorus hexaoxide)iron. Acta Cryst. November 1996, C52 (11): 2650–2652. doi:10.1107/S0108270196004398.