蒂普森-科恩反应
外观
(重定向自Tipson-Cohen反应)
蒂普森-科恩反应,最早由在华盛顿国家标准局的斯图尔特·蒂普森和亚历克斯·科恩首先报道。[1]
与锌粉和碘化钠在二甲基甲酰胺等溶剂中回流时,含两个相邻的伯磺酰氧基的糖转变为相应的不饱和糖。[2]
背景
[编辑]不饱和糖是重要的合成前体,可参与多种反应。[2]可用于天然产物和寡糖的合成,也可用作狄尔斯-阿尔德反应中的双烯体。[3]
蒂普森-科恩反应为同式(syn)或对式(anti)消除机理。产物为烯烃,产率中等。[4]反应受周边取代基的影响。下面是吡喃葡糖苷和吡喃甘露苷的反应机理。[4]

图1吡喃葡糖苷和吡喃半乳糖苷发生同式消除。[3]吡喃甘露苷则发生对式消除。[4]注:R基可为甲磺酰基 CH3SO2 (Ms)或对甲苯磺酰基CH3C6H4SO2 (Ts)。
反应机理
[编辑]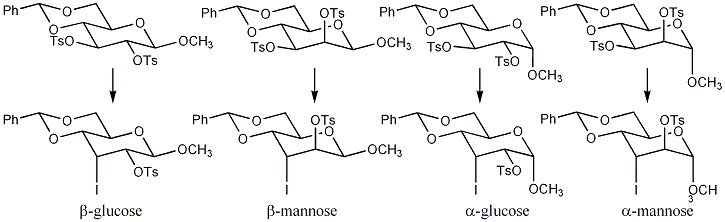
图2首步取代产生碘代物是反应的决速步,[4]生成的碘代物很快转化为不饱和糖,故很难检测到。以叠氮化物进行实验,证实亲核进攻发生在C-3,相应的含氮中间体可分离出来。
从β-吡喃葡糖苷、β-吡喃甘露糖苷、α-吡喃葡糖苷到α-吡喃甘露糖苷,反应活性逐渐降低。β-吡喃甘露苷比β-葡苷反应慢、产率低是因为其中含有一个与C-3相邻的直键磺酰氧基,[4]该直键基团导致过渡态中立体作用增加,产生不利的两个磺酰氧基间的重叠构象。α-葡苷中有一个β-反式的直键基团(即异头的甲氧基,相对C-3磺酰氧基),该基团同样导致上述两个基团间发生不利的立体作用。而α-甘露苷则同时具有β-甘露苷和β-葡苷的不利成分,所以速率最慢、产率也最低。[3]
反应条件
[编辑]| 底物a | 时间(小时) | 产率(%) |
|---|---|---|
| β-吡喃葡苷 | 0.5 | 85 |
| β-吡喃甘露苷 | 2.5 | 66 |
| α-吡喃葡苷 | 12 | 55 |
| α-吡喃甘露苷 | 15 | 10 |
a底物C-4和C-6有苄叉保护,异头位有甲氧基,C-2和C-3则有OTs基。反应温度95-100℃。
表1反应时间与产率与底物有关。作者比较四种底物性质后,发现β-吡喃葡苷是蒂普森-科恩反应的最佳底物。[3]
应用
[编辑]- 微波合成:产率更高(α-吡喃葡苷 - 88%),时间更短(14分钟)。[5]
- 蒂普森和科恩的原始文献中提到此反应也适用于非环糖。[1]
- 甲磺酰基和对甲苯磺酰基对比之下,对甲苯磺酰基底物产率更高、反应时间更短。[1],[6],[3]
参见
[编辑]参考资料
[编辑]- ^ 1.0 1.1 1.2 R.S. Tipson and A. Cohen, Carbohydrate Research, 1 (1965), 338-340.
- ^ 2.0 2.1 E.Albano, D. Horton, and T. Tsuchiya. Carbohydrate Research, 2 (1966), 349-362
- ^ 3.0 3.1 3.2 3.3 3.4 T. Yamazaki and K. Matsuda. Carbohydrate Research, 50 (1976), 279-281.
- ^ 4.0 4.1 4.2 4.3 4.4 T. Yamazaki and K. Matsuda. Journal of the Chemical Society, Perkin Transactions 1, 1 (1977), 1981-1984.
- ^ L. Baptistella, A. Neto, et al. Tetrahedron Letters, 34 (1993), 8407-8410.
- ^ E.Albano, D. Horton, and T. Tsuchiya. Carbohydrate Research, 2 (1966), 349-362.
