铀
已知的铀同位素都不稳定,其中以最长寿的铀-238(半衰期44.7亿年)和铀-235(半衰期7.04亿年)在自然界中最为普遍。铀是在地球上大量存在的太初元素中原子序最高的[3],原子序大于铀的超铀元素由于半衰期较短,从地球诞生至今早已衰变殆尽,且现今自然界中也缺乏形成它们的途径或机制,因此都是以人工合成的方法发现的,仅有镎和钚等原子序较小的超铀元素被发现在铀矿中痕量生成。自然界中的铀以三种同位素的形式存在:铀-238(占天然铀的99.2739至99.2752%)、铀-235(占0.7198至0.7202%)、和微量的铀-234(占0.0050至0.0059%)。[4]天然铀在衰变时会释放出α粒子。[5]由于天然铀同位素的半衰期极长,因此它们被用于估算地球的年龄。
铀独特的核子特性有很大的实用价值。铀-235是唯一易裂变的天然铀同位素,可被慢中子撞击而裂变,如果其质量超过临界质量,就都能够维持核链式反应,在核反应过程中的微小质量损失会转化成巨大的能量。这一特性使它广泛被用于核能发电以及生产核武器。然而,其在大自然存在的浓度很低,必须经过浓缩方可使用。耗尽铀-235后的发电原料被称为贫铀(组成以铀-238为主),可用做钢材添加剂,制造贫铀弹和装甲。铀-233也是一种易裂变同位素,唯自然存量极少,一般由天然的钍-232制备。铀-238自发裂变的概率极低,但快中子撞击可诱导其裂变,属于增殖性材料,即能在核反应堆中经核嬗变成为易裂变的钚-239。[6]
1789年,马丁·克拉普罗特在沥青铀矿中发现铀元素,并将其以天王星(Uranus)命名。尤金-梅尔希奥·皮里哥首次分离出铀金属。当时铀被用作玻璃和陶瓷的着色剂,能产生柠檬黄色至绿色,称为铀玻璃,而铀玻璃在紫外线照射下会散发绿色莹光。早期摄影曾使用铀为照片着色和晕渲。1896年,亨利·贝可勒尔发现铀的放射性。1934年起恩里科·费米、奥托·哈恩、莉泽·迈特纳及罗伯特·奥本海默等人进行研究,使铀成为核能工业所用的燃料和用于轰炸广岛的小男孩原子弹原料。冷战期间美国和苏联进行军备竞赛,生产数万个含铀或衰变产物为铀-235的钚-239的核武器。苏联解体后苏联核武器的安全问题受到公众的关注[7]。
特性
[编辑]
提纯后的铀金属呈银白色,属硬度较高的元素之一。铀金属具延展性和可锻性,呈轻微顺磁性,电正性高,电导性低。[8][9]铀金属的密度非常高,它比铅金属高70%,但比金及钨稍低。
几乎所有非金属元素及其化合物都可与铀发生反应,反应活性随温度而提高。[10] 铀可快速溶于室温下的盐酸,而硝酸在加热条件下也可将铀溶解,而除氢氯酸外的非氧化性酸对铀的侵蚀则很慢。[8]铀金属粉末可与冷水反应。空气中,铀的表面会形成一层深色氧化铀。[9]矿石中的铀可通过化学方法提取出来,并转化为二氧化铀或其他工业可用的化学形态。
铀-235是首个被发现的易裂变同位素。其他自然产生的同位素为“可裂变”物质,而非“易裂变”(两者之别请见易裂变材料)。在慢中子的撞击下,铀-235主要会裂变成两个较小的原子核,同时释放核结合能及更多的中子。当这些新产生的中子被足够多的原子核吸收,就会产生核链式反应,瞬时发热或(在特殊情况下)发生爆炸。核反应堆会使用中子毒物,通过吸收多余的自由中子,来控制这类核链式反应的速度。这种吸收中子的物质通常置于反应堆的控制棒中。
只要大约7公斤的铀-235就能够制成原子弹。[11]首次用于战争中的核弹小男孩原子弹使用的便是铀元素的核裂变反应,而三位一体核试验首个核弹“小工具”(The Gadget)及摧毁长崎的胖子原子弹用的则是钚元素。
U(铀)-238 —(α衰变)—> Th(钍)-234 —(β衰变)—> Pa(镤)-234 —(β衰变)—> U(铀)-234 —(α衰变)—>
Th(钍)-230 —(α衰变)—> Ra(镭)-226 —(α衰变)—> Rn(氡) -222 —(α衰变)—> Po(钋)-218 —> a. 或 b.
a. —(α衰变)—> Pb(铅)-214 —(β衰变)—> Bi(铋)-214 —> c. 或 d.
b. —(β衰变)—> At(砹)-218 —(α衰变)—> Bi(铋)-214 —> c. 或 d.
c. —(α衰变)—> Tl(铊)-210 —(β衰变)—> Pb(铅)-210 —> e. 或 f. 或 g.
d. —(β衰变)—> Po(钋)-214 —(α衰变)—> Pb(铅 -210) —> e. 或 f. 或 g.
e. —(α衰变)—> Hg(汞)-206 —(β衰变)—> Tl(铊)-206 —(β衰变)—> Pb(铅)-206 [稳定]
f. —(β衰变)—> Bi(铋)-210 —(α衰变)—> Tl(铊)-206 —(β衰变)—> Pb(铅)-206 [稳定]
g. —(β衰变)—> Bi(铋)-210 —(β衰变)—> Po(钋)-210 —(α衰变)—> Pb(铅)-206 [稳定]
化合物
[编辑]氧化态与氧化物
[编辑]氧化物
[编辑]氧铀系统中物质的相态非常复杂。铀的最常见氧化态为铀(IV)和铀(VI),分别对应于二氧化铀(UO
2)和三氧化铀(UO
3)。[13]其他存在的氧化物还有一氧化铀(UO)、五氧化二铀(U
2O
5)、过氧化铀(UO
4·2H
2O)等等。
八氧化三铀(U
3O
8)和二氧化铀(UO
2)是铀最常见的氧化物。这两种氧化物都是固体,不易溶于水,在许多化学环境下都相对稳定。八氧化三铀是最稳定的铀氧化物,也是自然界中最常见的一种。二氧化铀则是核反应堆中最常用的铀燃料。在环境温度下,UO
2会逐渐转变为U
3O
8。因为铀的氧化物都较稳定,所以铀是以氧化物的形态储存和弃置的。[14]
水溶化学
[编辑]
铀具有不同氧化态的盐,当中不少都溶于水,可在水溶液中进行研究。铀的最常见离子态为U3+
(棕红色)、U4+
(绿色)、UO+
2(不稳定)及UO2+
2(黄色),分别对应于U(III)、U(IV)、U(V)和U(VI)。[15]铀(II)氧化态有UO和US等固态及半金属化合物,但没有可溶的简单离子。U3+
离子不稳定,会从水中释放出氢气。铀(VI)态对应铀酰(UO2+
2)离子,有碳酸铀酰、氯化铀酰和硫酸铀酰等化合物。UO2+
2能和各种有机螯合剂形成配合物,其中醋酸铀酰最为常见。[15]
各种铀酰和氧化铀阳离子都可溶于水,但铀酸盐并不溶于水[16]:1269[17]:158-160。
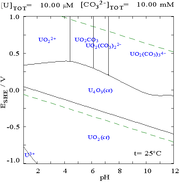
碳酸盐
[编辑]当铀(VI)溶于碳酸盐溶液而非纯水中时,其普尔贝图会因与碳酸离子的相互作用而有很大的变化。虽然大部分碳酸盐都不溶于水,但碳酸铀却是可溶的。这是由于铀(VI)阳离子可以与两个氧化物及至少三个碳酸盐形成阴离子配合物。
 |
 |
 |
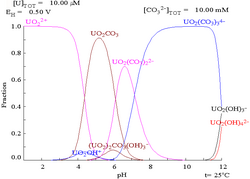 |
| 非配合物水溶液中的铀(如高氯酸和氢氧化钠)[18] | 碳酸盐溶液中的铀 | 非配合物水溶液中铀的各个化学形态相对浓度[18] | 碳酸盐溶液中铀的各个化学形态相对浓度[18] |
酸碱度的影响
[编辑]从铀的化学形态比例图可以推论,铀(VI)溶液的pH值提升,会使铀形成水合氢氧化铀,并在高pH值时形成氢氧化配合物阴离子。
当加入碳酸盐后,pH值的提高会使铀转化为一系列的碳酸盐配合物形态。特别在pH在6至8的时候,铀的可溶性会提高,这有助长期稳定储藏乏核燃料中的氧化铀。
氢化物、碳化物及氮化物
[编辑]铀金属在加热至250到300摄氏度时,会与氢反应,形成氢化铀。继续加热则会再次去除氢。因此氢化铀可用于制造铀的各种碳化物、氮化物和卤化物。[19]氢化铀具有两种晶体相态:α型存在于低温环境下,β型则在250 °C以上出现。[19]
碳化铀与氮化铀都是相对惰性的半金属物质,能少许溶于酸中,并会与水反应及在空气中点燃形成U
3O
8。[19]铀的碳化物包括一碳化铀(UC)、二碳化铀(UC
2)和三碳化二铀(U
2C
3)。向熔化铀加入碳,或在高温下把铀金属置于一氧化碳中,可产生UC和UC
2。U
2C
3在1800 °C以下稳定,通过对UC和UC
2的混合物进行机械施压可以形成。[20]铀金属在直接接触氮后所形成的氮化铀包括:一氮化铀(UN)、二氮化铀(UN
2)及三氮化二铀(U
2N
3)。[20]
卤化物
[编辑]

所有的氟化铀都是从四氟化铀(UF
4)转化而成的,UF
4则由二氧化铀经氢氟化反应形成。[19]UF
4与氢在1000 °C反应后,会还原成三氟化铀(UF
3)。在适当的温度和压力下,固态UF
4与气态六氟化铀(UF
6)反应后,可产生氧化态介乎两者之间的氟化物:U
2F
9、U
4F
17和UF
5。[19]
在室温底下,UF
6具有高蒸气压,这有助于用气体扩散法把铀-235从比例更高的铀-238同位素中分离出来。通过以下反应,二氧化铀和氢化铀就能形成六氟化铀。[19]
- UO
2 + 4 HF → UF
4 + 2 H
2O(500 °C,吸热) - UF
4 + F
2 → UF
6(350 °C,吸热)
所形成的UF
6是一种白色固体,化学活性极高(进行氟化反应),容易升华(其气态接近理想气体)。它是已知的铀化合物中挥发性最强的。[19]
要制造四氯化铀(UCl
4),可以直接将氯与铀金属或氢化铀结合。如果用氢还原UCl
4,可产生三氯化铀(UCl
3);进一步进行氯化反应,则可产生氧化态更高的氯化铀。[19]所有氯化铀都能与水和空气反应。
铀的溴化物和碘化物可通过将铀直接与溴或碘反应形成,或在氢溴酸或氢碘酸中加入UH
3。[19]这些化合物有UBr
3、UBr
4、UI
3和UI
4等等。铀的氧卤化物均可溶于水,例如UO
2F
2、UOCl
2、UO
2Cl
2和UO
2Br
2。卤素的原子量越高,对应的氧卤化物稳定性就越低。[19]
历史
[编辑]史前天然裂变
[编辑]1972年,法国物理学家弗朗西斯·佩兰分别在西非加蓬奥克洛的3个矿床中,发现了15处古天然核反应堆,今天已不再活跃。该矿床的年龄为17亿年,当时地球上的铀中,铀-235占3%。[21]在适当环境下,这足以激发并维持核链式反应。
史前应用
[编辑]人类最早使用铀的天然氧化物,可以追溯到公元79年以前。当时氧化铀被用来为陶瓷上黄色的彩釉。[9]1912年,英国牛津大学的R. T. Gunther在意大利那不勒斯湾波希里坡海角的古罗马别墅中,发现了含1%氧化铀的黄色玻璃。[22]从欧洲中世纪晚期开始,波希米亚约阿希姆斯塔尔(今捷克亚希莫夫)的居民就使用哈布斯堡银矿中提取的沥青铀矿来制造玻璃。[23]19世纪初,人们所知的铀矿仅在以上的地点。
发现
[编辑]铀元素是由德国化学家马丁·克拉普罗特发现的。1789年,他在位于柏林的实验室中,把沥青铀矿溶解在硝酸中,再用氢氧化钠中和,成功沉淀出一种黄色化合物(可能是重铀酸钠)。[23]克拉普罗特假设这是一种未知元素的氧化物,并用炭进行加热,得出黑色的粉末。他错误地认为这就是新发现的元素,但其实该粉末才是铀的氧化物。[23][24]他以威廉·赫歇尔在八年前发现的天王星(Uranus)来命名这种新元素,而天王星本身是以希腊神话中的天神乌拉诺斯命名的。同样地,百年后科学家发现首个超铀元素镎(Neptunium)时也遵循铀的命名方式以海王星(Neptune)命名之,其后的钚(Plutonium)则以冥王星(Pluto)命名。[25]
1841年,巴黎中央工艺学校(Conservatoire National des Arts et Métiers)分析化学教授尤金-梅尔希奥·皮里哥把四氯化铀和钾一同加热,首次分离出铀金属。[23][26]19世纪时人们没有意识到铀的放射性及危险性,因此发展了各种铀的日常应用,其中包括历史流传下来的陶瓷和玻璃上色。
放射性的发现
[编辑]
1896年,亨利·贝可勒尔在位于巴黎的实验室中,使用铀元素发现了放射性。[10]贝可勒尔将硫酸铀酰钾(K2UO2(SO4)2)放在底片上,并置于抽屉当中。取出之后,他发觉底片出现了雾状影像,且使用其他铀盐甚至铀金属,也会有一样的效果。[27]他得出结论,铀会发出一种不可见光或射线,在底片上留下了影像。
1898年,格哈德·卡尔·施密特和玛丽·居里先后独立观察到钍元素也具有放射性。[28][29][30]
核裂变研究
[编辑]
以恩里科·费米为首的一个团队在1934年观察到,对铀进行中子撞击会产生β射线(即释放出电子或正子)。[31]这些裂变产物起初被误以为是原子序为93和94的新元素,它们分别被命名为Ausonium和Hesperium。[32][33][34][35]奥托·哈恩和弗里茨·施特拉斯曼在哈恩位于柏林的实验室中进行了此项实验,发现了铀能够裂变成为更小的原子核,并释放出核结合能。[31]莉泽·迈特纳和她的侄子奥托·罗伯特·弗里施于1939年2月刊登了该现象的物理解释,并将这种过程称为“核裂变”。[36]不久之后,费米猜测铀的裂变所释放的中子可能足以使这一裂变持续进行。1939年,这一假说得到了证实。科学家也发现,占少数的铀-235同位素每次裂变平均可产生2.5个中子;[31]而占多数的铀-238则可经核嬗变变为钚,而钚就像铀-235一样,能够进行释放热中子的核裂变。这一发现促使多国开始进行制造核武器及运用核能的相关研究。
1942年9月2日,美国曼哈顿计划中同样以费米为首的另一团队成功产生了首次人造核链式反应,称Chicago Pile-1。团队在芝加哥大学一个美式橄榄球场地底进行此项实验,其中使用了360吨石墨、53吨氧化铀和5.5吨铀金属。[31][37]
原子弹
[编辑]第二次世界大战,美国主要研发了两种原子弹:一种主要含铀的炸弹,其中的可裂变物质为高浓缩铀(代号“小男孩”);另一种为主要含钚的炸弹,其钚元素源自铀-238(见三位一体核试及胖子原子弹)。“小男孩”是首个被用于战争当中的核武器,它在1945年8月6日于日本广岛上空爆炸。其爆炸当量为12,500吨TNT炸药,引爆后的热冲击波摧毁了5万幢房屋,导致7.5万人死亡。(见广岛与长崎原子弹爆炸)。[27]起初人们以为铀是一种稀有元素,透过垄断所有现有铀存库便可避免核扩散。然而不过10年,大型铀矿就在世界各地相继被发现。[38]
反应堆
[编辑]
位于美国田纳西州橡树岭国家实验室的X-10石墨反应堆是世界上第二个人造核反应堆 ,也是第一个为持续作业而造的核反应堆。爱达荷州阿科镇阿贡国家实验室的EBR-I(实验增殖反应堆一号)在1951年12月20日成为了首个产生电力的核反应堆。[39]最初该反应堆只点亮了4个150瓦灯泡,但经过改进,它最终可为整个实验室供电。(其后,阿科镇成为了世界上首个完全依赖核电的小镇,其电力来自阿贡国家实验室的另一个核能发电机BORAX-III。)[40][41]全球首个商业规模核电站是位于前苏联的奥布宁斯克核电站,它于1954年6月27日投入使用。1954年,鹦鹉螺号成为了第一个使用核动力的潜水艇。[31][42]
核污染及冷战后患
[编辑]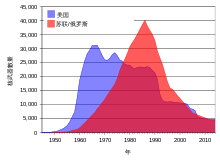
苏联及美国在1950年代至1960年代初,以及法国在1970至1980年代所进行的地面核试验[43]使大量含有铀的子同位素的辐射落尘散布在世界各地。[44]多次核事故也加剧了放射性污染。[45][46]
铀矿工人患癌症的机会比其他人较高。例如,有证据显示纳瓦霍铀矿工人有较高机会患肺癌。[47]美国1990年通过的辐射曝露补偿法规定,对所有确诊患有癌症或其他呼吸道疾病的铀矿工人给予10万美元慰问金。[48]
美苏冷战期间,两国收集并囤积了大量的铀,并用此制造了上万个核武器。在1991年苏联解体之后,540吨武器级高浓缩铀(足以制成4万个核弹头)被存放在监管不严的地点,散布在俄罗斯联邦及其他前苏联国家。[11]亚洲、欧洲及南美洲各国警方在1993年和2005年之间,至少有16次截获到走私的武器级铀和钚,大部分都来自前苏联。[11]美国联邦政府在1993年至2005进行了材料保护、控制和衡算项目,动用了5.5亿美元来保护位于俄罗斯的铀钚存库。[11]《科学美国人》在2006年2月刊登文章,指出其中一处设施在改善项目进行之前,浓缩铀是存放在扫帚柜的,用来记录核弹头的卡片则放在鞋盒中。[49]
同位素
[编辑]自然丰度
[编辑]天然铀元素主要由三种同位素组成:铀-238(丰度为99.28%)、铀-235(0.71%)和铀-234(0.0054%)。它们均具有放射性,会释放α粒子,但也有较小机会进行自发裂变。
铀-238是最稳定的铀同位素,半衰期约为4.468×109年,与地球的年龄相约。铀-235的半衰期约为7.13×108年,而铀-234的半衰期则约为2.48×105年。[50]天然铀所释放出的α粒子中,49%来自238U,同样有49%来自234U,最后约2.0%来自235U。地球刚刚形成的时候,约有五分之一的铀是铀-235,而234U的丰度则很可能比今天低得多。
铀-238通常发生α衰变(有时也会进行自发裂变),其衰变链被称为铀衰变系。该衰变系包含18种核素,最终的产物则是稳定核素铅-206,整个衰变链由多种衰变途径组成。[10]
铀-235的衰变链被称为锕衰变系,其中有15种核素,最终产物是稳定的铅-207。[10]由于这些衰变系的衰变速率是不变的,因此有助于对比母子原子核的丰度,从而进行放射性定年法。
铀-234也属于铀衰变系中的一员,因此它会最终衰变为铅-206。
铀-233是通过在核反应堆中对钍-232进行中子撞击而形成的。铀-233是可裂变物质,[9]其衰变系的最后一种核素为铊-205。
铀-235在核反应堆和核武器中有着十分重要的作用,因为它是自然界中唯一一种大量存在的可裂变铀同位素。它能够在热中子撞击下,裂变成多个碎片,从中释放出可用的能量。[10]
铀-238不可裂变,但则是可转换同位素,能够经中子活化变为可裂变的钚-239。铀-238可吸收一颗中子,形成铀-239。239U会经β衰变成为镎-239,并在几天内再β衰变为钚-239。239Pu是三位一体核试中世界首个原子弹所使用的可裂变物质。[31]
浓缩铀
[编辑]
自然界中的铀是由99.2742%的铀-238和0.7204%的铀-235组成的。同位素分离过程将可裂变的铀-235的浓度提高,以产生核武器和发电所用的浓缩铀。铀-235原子裂变所释放的中子会被其他铀-235原子吸收,促发更多的裂变反应,持续核链式反应。达到核链式反应所需的铀-235质量称为临界质量。
浓缩铀的铀-235含量一般介乎3%到5%。[51]浓缩过程会产生大量不含铀-235的物质,称为贫铀。贫铀中铀-235的含量不超过0.3%。[52]铀的价格从2001年至2007年不断上升,使铀-235含量超过0.35%的铀重新进行浓缩过程。贫六氟化铀的价格因此从2001的每公斤5美元升至2007年的130美元以上。[52]
最常用的铀浓缩方法是气体离心法,即利用235UF6和238UF6分子量上的差异,把含有铀-235的六氟化铀离心分离出来。[27]气体扩散法是人们最先使用的浓缩方法,曾用于美国曼哈顿计划。该方法将六氟化铀重复透过银锌薄膜扩散,利用同位素间扩散率的不同分离出铀-235(铀-238的原子量更高,因此扩散率较低)。[27]分子激光同位素分离法用具有特定能量的激光束把铀-235与氯之间的分子键断开,但保留铀-238与氯间的键合。铀-235便能以金属态从溶液中沉淀分离出来。[6]原子蒸气激光同位素分离法(AVLIS)使用的则是发出可见光的可调激光器,如染料激光器等。[53]另一种浓缩方法为液态热扩散法。[8]
存量
[编辑]生物及非生物存量
[编辑]
铀是一种天然元素,在各类岩石、土壤和水里都会少量出现。在地球的地壳当中,铀的丰度在所有元素中排列第51。铀也是在地球上大量存在的元素中原子序最高的。与所有原子量大于铁的元素一样,铀只能在超新星爆炸中自然产生。[54]地幔的热量主要来自当中铀、钍和钾-40的衰变。[55][56]这一热量使得地球的外核保持液态,也推动着地幔对流,从而导致板块移动。
铀在地壳中的平均含量为百万分之2至4,[8][43]约为银的40倍。[10]从地表至地底25公里一层内,估计含有1017 kg铀,而海洋里则可能有1013 kg铀。[8]泥土中铀的含量为百万分之0.7至11(由于使用磷肥料,农田土壤中铀浓度可高达百万分之15),在海中则是十亿分之3。[43]
铀的含量比锑、锡、镉、汞和银要高,并和砷和钼相约。[9][43]数百种矿石都含有铀,如沥青铀矿(最常见的铀矿石)、钒酸钾铀矿、钙铀云母、硅钙铀矿、铜铀云母、水硅铀矿等等。[9]一些其他物质里也有明显较高的铀含量,如磷矿石、褐煤、独居石等。[9]一些加工厂能够从含铀量低至0.1%的物质中提取出铀。[10]

腐败希瓦菌和铁还原地杆菌等的某些细菌可以将铀(VI)还原成铀(IV)。[57]某些生物,如地衣Trapelia involuta和微生物柠檬酸杆菌能够使内部铀浓度比周围环境高300倍。[58]柠檬酸杆菌在甘油磷酸(或其他类似的有机磷酸化合物)存在的情况下,可吸收铀酰(UO2+
2)离子。在一天以后,一克细菌可以产生9克磷酸铀酰晶体。这意味着可以用这一些物种对受到核污染的水源进行生物修复。[23][59]
自然界中的铀(VI)在碱性环境下会形成可溶性很高的碳酸盐配合物。这使得核废料中的铀能够轻易流动至地下水源和泥土中,对环境造成污染破坏。然而在碱性环境下,当存在过量碳酸盐时,很难将铀以磷酸铀的形式沉淀出来。[60]
植物会从泥土中吸取部分铀。如果去水后以重量计,那铀在植物中的含量为十亿分之5至60,而木材燃烧后的灰烬中可含有百万分之4的铀。[23]食用植物中,铀的去水重量比一般较低。人类每天从食物中吸收1至2微克的铀。[23]
采矿与生产
[编辑]

2010年世界铀产量为53,663吨,其中17,803吨(33.2%)采自哈萨克斯坦。其他主要铀生产国还包括:加拿大(9,783吨)、澳洲(5,900吨)、纳米比亚(4,496吨)、尼日尔(4,198吨)和俄罗斯(3,562吨)。[61]
开采铀矿的方法包括:露天开采、地下开采、原地浸出和钻孔开采等。[6]开采出的低浓度铀矿包括0.01至0.25%的氧化铀,经复杂的过程可从中提炼出铀金属。[62]采自加拿大萨斯喀彻温阿萨巴斯卡盆地矿藏的高浓度铀平均可含有高达23%的氧化铀。[63]铀矿石要压碎至粉末状,再经酸或碱浸滤。浸滤液需通过沉淀、溶液萃取和离子交换,形成一种称为“黄饼”的铀精矿,含有至少75%氧化铀(U3O8)。黄饼要经煅烧以移除磨粉过程中的杂质,再送往精炼和化学转换工序。[64]
用碱金属或碱土金属对卤化铀进行还原反应,可制成商用铀。[9]KUF
5或UF
4电解后,溶于熔化的氯化钙(CaCl
2)和氯化钠(NaCl)中,也可产生铀金属。[9]卤化铀放在热灯丝上经热降解,可形成高纯度铀。[9]
资源储备
[编辑]
经估计,全球目前有550万吨铀库存,每磅铀可售59美元;[65]另有3500万吨铀尚待开采。[66]铀价格从2003年5月的每磅10美元升至2007年7月的每磅138美元。这促使了人们对铀的开采:[65]2005年世界为铀开采花费2亿美元,比2004年高出54%;[66]2006年世界花费7.74亿美元,比2004年高出250%。[65]
澳洲拥有全球已知铀矿藏的31%。[67]世界上最大的单个铀矿藏并位于南澳州的奥林匹克大坝矿山。[68]中非共和国姆博穆省贝库玛也拥有大型铀矿藏。
“百万吨变百万千瓦”等类似计划通过拆卸核武器,将可用物质转变为核燃料。[69]
海水中铀浓度很低,但蕴藏量巨大,约45亿吨,是陆地上已探明的铀矿储量的2000倍。1960年代后期,中国华东师范大学在世界上首次从海水中提取出公斤级的铀。[70]1980年代,日本科学家证明,用离子交换法从海水萃取铀元素在技术上是可行的。为此,日本已于1986年4月在香川县建成了年产10千克铀的海水提取厂。[71][72]科学家曾进行从海水中提取铀的实验,[73]但由于水中含有碳酸盐,使铀产量很低。2012年,美国橡树岭国家实验室的研究人员宣布成功研发了一种称为HiCap的新型吸附剂,能比过去的吸附剂更好地保留固体或气体分子、原子和离子。研究人员称,这种材料提取出的铀比过去多5至7倍。[74][75]
供应
[编辑]
2005年共有17个国家生产高浓度氧化铀,其中哈萨克斯坦(占全球产量的35.6%)和加拿大(16.7%)为最大产国,其他主要产国还包括澳洲(11.0%)、尼日尔(8.0%)、纳米比亚(6.0%)、乌兹别克斯坦(5.5%)、俄罗斯(5.5%)、阿根廷(2.1%)、美国(2.8%)及中国(2.7%)等。[77]2004年国际原子能机构预计地球上的所有铀矿藏估计足够供应未来85年的需求,[66]但也有研究指出,20世纪末投资不足,可能对21世纪的铀供应带来压力。[78]铀矿藏量与矿石含铀量呈对数正态分布。矿石含铀量降低10倍,可开采的铀矿量就会提高300倍。[79]也就是说,矿石含铀量越高,可开采量则越低,反之亦然。
应用
[编辑]军用
[编辑]
铀在军事方面的应用主要在于制造高密度穿甲弹。这种穿甲弹由贫铀组成,并掺有1至2%其他元素,形成合金。在高速击中目标时,由于其高密度、高硬度,并具有自燃性,它能够有效摧毁重装甲目标。坦克及其他车辆的装甲中也有使用贫铀。英、美及其他各国在波斯湾和巴尔干作战时使用了贫铀军备,由于可能在泥土中留下了铀元素,因此引起了环境安全及政治上的争论。[11]
贫铀可用于制造储存或运载放射性物质的容器外壳。虽然铀本身具有放射性,但其高密度使它比铅元素更有效于阻挡强烈的辐射,例如镭所产生的辐射。[8]其他贫铀的应用包括飞机控制面的平衡物以及导弹进入大气层时的压载和保护性外壳。[9]由于密度极高,贫铀可用在惯性导航系统和陀螺仪式指南针当中。[9]贫铀比其他同样高密度的物质优胜,因为其加工、铸造简单,价格相对也较低。[43]接触贫铀时的主要危险在于氧化铀中毒,而非辐射(铀是一种弱α粒子射源)。
在第二次世界大战晚期和整个冷战期间,多国利用铀-235作为可裂变爆炸物制造核武器。最初制成的有两种核弹:第一种使用铀-235,相对简单;另一种使用经转化铀-238形成的钚-239。之后生产的为更复杂,爆炸力也更大的裂变聚变核弹(氢弹),使用钚装置使氚氘混合物进行核聚变。这种核弹的外壳是不可裂变的铀(即贫铀),核聚变产生的快中子使该物质裂变,产生爆炸中超过一半的能量。[80]
民用
[编辑]

铀在民间主要在核电站中作核燃料用。假设完全裂变,一公斤的铀-235理论上可以产生80万亿焦耳的能量(8×1013焦耳),相等于3000吨煤。[6]
商业核电站所用的铀一般含有3%的铀-235同位素。[6]CANDU和Magnox反应堆是能够使用非浓缩铀作为燃料的仅有的两种反应堆。美国海军所用的核反应堆通常使用高浓缩铀,铀-235的比例较高(实际百分比被列为机密)。快中子增殖反应堆可经过以下反应将铀-238转化为钚:[9] 238U (n, γ) → 239U -(β) → 239Np -(β) → 239Pu.
在放射性被发现之前,铀主要被用在黄色玻璃及陶器彩釉当中,如铀玻璃等。
玛丽·居里在铀矿石(沥青铀矿)中发现并分离出镭元素,激发了人们对铀矿进行开采,将提取出的镭制成萤光油漆,用于钟表和飞机仪表盘上。[81]由于要处理3吨铀矿才能提取出1克镭,这产生了大量的含铀副产品。这些副产品都送往彩釉工业,使得含铀彩釉的价格大大降低。除了陶器以外,铀还被用在瓦片中,可制成红、蓝、绿、黄、紫红、黑等多种颜色。
铀也被用在摄影学化学物(特别是用作调色剂的硝酸铀)、[9]灯丝以及皮革、木材的染料当中。铀盐可作为丝绸和样貌的媒染剂。乙酸铀酰和甲酸铀酰在透射电子显微镜中被用作富含电子的染料,在为超薄切片、单独细胞器和高分子成像时,及在对病毒进行负染色法时提高标本与环境的对比度。
铀的放射性的发现促进了更多在科学及日常中对铀的应用。由于铀-238同位素的半衰期很高(4.51×109年),因此被用来估计最远古火成岩的年龄。其他用到铀的放射性定年法包括铀钍定年法、铀铅定年法和铀铀定年法。在产生高能X射线时所用的目标体中也用到铀。[9]
安全
[编辑]人类吸入受污染空气或摄入受污染的水和食物,铀(及其衰变产物,如氡等)就会进入人的体内。空气中的铀通常非常少,但在磷化肥处理厂、核武器研究中心、煤发电厂、铀矿、铀矿石和浓缩铀处理厂中工作的人员,以及居住在曾使用贫铀作为武器的战地附近的人,就会有较高的铀摄入量。[82][83]位于地底铀矿藏上的房屋建筑中会有较多的放射性氡气。
中华民国劳动部职业安全卫生署订定八小时的工作天内,工作场所铀的浓度在0.25 mg/m3为可接受的范围,而美国国家职业安全卫生研究所则建议八小时工作天内暴露浓度不应超过0.25 mg/m3,短时间内则不可超过0.6 mg/m3,而在10 mg/m3的浓度下,铀有立即的危险性。
大部分进食到体内的铀会在消化过程后排出。当氧化铀等不可溶的含铀物质进入身体后,只有大约0.5%会被吸收;如果可溶性较高的铀酰离子进入体内,身体所吸收的量可以高达5%。[23]不过,可溶的比不可溶的铀化合物能够更快地离开身体,特别是当不可溶铀化合物经尘埃进入肺部之后,会对人体造成更大的伤害。在进入血液后,铀会因亲磷性而积累在骨骼组织内,并停留多年。[23]人的皮肤不会吸收铀,且铀所释放的α粒子也无法穿透皮肤。
合成的铀则会形成铀离子,并会累积于骨骼、肝、肾、以及生殖器官之组织。铀可被钢表面或含水层给净化。
影响
[编辑]留在体内的铀会影响肾、脑、肝、心的正常运作,除了微弱放射性以外,其本身的化学毒性也会对身体的其他器官造成伤害。[23][84][85]铀是一种生殖毒物。[86][87]因为铀-238主要释放的α辐射具有较小的穿透范围,所以放射性只会对小部分组织造成影响。三氧化铀、硝酸铀酰及其他六价铀化合物中的铀酰(UO2+
2)离子在实验动物身上,造成了先天缺陷和免疫系统破坏。[88]美国疾病控制与预防中心曾发表过研究指出,天然及贫铀仍没有造成过人类癌症个案,[89]但是铀及其衰变产物(特别是氡)对人体健康有极大的威胁。[43]曝露在铀下不代表暴露在其核裂变产物锶-90、碘-131的风险下,但在制药过程、核反应堆、或核爆现场就有暴露在其下的危险。[90]
虽然暴露在高浓度的六氟化铀对人体有致命性的伤害,但死因通常为氢氟酸以及氟化铀酰的产生,而不是铀本身的毒性。[91]铀金属的小碎片有易燃的风险,而铀金属粉末甚至可以在室温下在空气中自燃,造成火灾。[9]
研究人员在接触铀金属时,都会使用手套作保护。[92]在处理及存放含铀度高的物质时,须避免意外摄入。[92]
| 器官系统 | 症状 | 生理功能异常 | 实验研究 |
|---|---|---|---|
| 肾 | 提高尿中尿蛋白、过氧氢化酶浓度以及利尿 | 对肾小管造成伤害、管上皮细胞与肾元细胞坏死 | N/A |
| 脑/中枢神经系统 | 认知神经测试表现失常 | 急性胆碱能神经中毒
大脑皮质、中脑、蚓部产生依赖性累积 、海马回电生理异常 |
N/A |
| DNA | 癌症病例增加[48][93][94][95][96][97] | 基因突变率增加、肿瘤数目增加 | 出现具微核的双核细胞,抑制细胞周期及增殖、姊妹染色体异常增生、基因具致癌表现型 |
| 骨骼/肌肉 | N/A | 牙周之骨骼生成及肺泡伤害复原受抑制 | N/A |
| 生殖系统 | 铀矿矿工之第一胎多为女性 | 睾丸间质内细胞空化 | N/A |
| 呼吸系统 | 目前未证实有不利之影响 | 严重的鼻塞及鼻出血、肺病变、纤维化、水肿、癌 | N/A |
| 肠胃 | 呕吐、腹泻、尿蛋白 | N/A | N/A |
| 肝 | 未发现在暴露剂量下有影响 | 脂肪肝、局限性坏死 | N/A |
| 皮肤 | 尚未有暴露剂量评估之数据 | 空化表皮细胞肿胀、毛囊及皮脂腺受损 | N/A |
| 嵌入体内之贫铀碎片周围组织 | 含铀尿浓度提高 | 含铀尿浓度提高、神经心理测验及生化测试异常 | N/A |
| 免疫系统 | 慢性疲劳、皮疹、眼耳感染、发量降低、体重减轻、咳嗽,可能是铀之化合物之影响,而非贫铀本身 | N/A | N/A |
| 眼 | N/A | 结膜炎、刺激性发炎、水肿、结膜囊溃疡 | N/A |
| 血液 | N/A | 红血球数量、血红素含量降低 | N/A |
| 心血管 | 因摄入铀所导致之心肌炎、摄入后六月即痊愈 | 无影响 | N/A |
参见
[编辑]参考文献
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ Morss, L.R.; Edelstein, N.M. and Fuger, J. (编). The Chemistry of the Actinide and Transactinide Elements 3rd. Netherlands: Springer. 2006. ISBN 9048131464.
- ^ Heaviest naturally occurring element. Guinness World Records. [2019-12-30]. (原始内容存档于2021-05-16) (英国英语).
- ^ Uranium Isotopes. [2012-03-14]. (原始内容存档于2011-01-19).
- ^ WWW Table of Radioactive Isotopes. Lawrence Berkeley National Laboratory, Berkeley, US. (原始内容存档于2007-04-27).
- ^ 6.0 6.1 6.2 6.3 6.4 Emsley 2001,第479页.
- ^ "U.S. to pump money into nuke stockpile, increase security," (页面存档备份,存于互联网档案馆) RIA Novosti 18 February 2010
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 Uranium. The McGraw-Hill Science and Technology Encyclopedia 5th. The McGraw-Hill Companies, Inc. ISBN 0-07-142957-3.
- ^ 9.00 9.01 9.02 9.03 9.04 9.05 9.06 9.07 9.08 9.09 9.10 9.11 9.12 9.13 9.14 9.15 Hammond, C. R. The Elements, in Handbook of Chemistry and Physics 81st edition (PDF). CRC press. 2000 [2013-07-23]. ISBN 0-8493-0481-4. (原始内容 (PDF)存档于2008-06-26).
- ^ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 uranium. Columbia Electronic Encyclopedia 6th. Columbia University Press. [2013-07-23]. (原始内容存档于2011-07-27).
- ^ 11.0 11.1 11.2 11.3 11.4 uranium. Encyclopedia of Espionage, Intelligence, and Security. The Gale Group, Inc. [2013-07-23]. (原始内容存档于2011-07-27).
- ^ Rollett, A. D. Applications of Texture Analysis. John Wiley and Sons. 2008: 108. ISBN 0-470-40835-9.
- ^ Seaborg 1968,第779页.
- ^ Chemical Forms of Uranium. Argonne National Laboratory. [2007-02-18]. (原始内容存档于2006-09-22).
- ^ 15.0 15.1 Seaborg 1968,第778页.
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ^ (简体中文)唐任寰等. 《无机化学丛书》第十卷:锕系、锕系后元素 第一版. 北京: 科学出版社. 1990. ISBN 9787030305725.
- ^ 18.0 18.1 18.2 18.3 Puigdomenech, Ignasi Hydra/Medusa Chemical Equilibrium Database and Plotting Software (2004) KTH Royal Institute of Technology, freely downloadable software at 存档副本. [2007-09-29]. (原始内容存档于2007-09-29).
- ^ 19.00 19.01 19.02 19.03 19.04 19.05 19.06 19.07 19.08 19.09 Seaborg 1968,第782页.
- ^ 20.0 20.1 Seaborg 1968,第780页.
- ^ Oklo: Natural Nuclear Reactors. Office of Civilian Radioactive Waste Management. [2006-06-28]. (原始内容存档于2004-06-03).
- ^ Emsley 2001,第482页.
- ^ 23.00 23.01 23.02 23.03 23.04 23.05 23.06 23.07 23.08 23.09 Emsley 2001,第477页.
- ^ Klaproth, M. H. Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz. Chemische Annalen. 1789, 2: 387–403.
- ^ Uranium. The American Heritage Dictionary of the English Language 4th. Houghton Mifflin Company. [2013-07-23]. (原始内容存档于2011-07-27).
- ^ Péligot, E.-M. Recherches Sur L'Uranium. Annales de chimie et de physique. 1842, 5 (5): 5–47 [2013-07-23]. (原始内容存档于2010-08-22).
- ^ 27.0 27.1 27.2 27.3 Emsley 2001,第478页.
- ^ Curie, M. Rayons émis par les composés de l'uranium et du thorium [Rays emitted by compounds of uranium and thorium]. Comptes Rendus. 1898, 126: 1101–1103. OL 24166254M (法语).
- ^ Schmidt, G. C. Über die vom Thorium und den Thoriumverbindungen ausgehende Strahlung [On the radiation emitted by thorium and thorium compounds]. Verhandlungen der Physikalischen Gesellschaft zu Berlin. 1898, 17: 14–16 (德语).
- ^ Schmidt, G. C. Über die von den Thorverbindungen und einigen anderen Substanzen ausgehende Strahlung [On the radiation emitted by thorium compounds and some other substances]. Annalen der Physik und Chemie. 1898, 65 (5): 141–151 [2023-09-13]. Bibcode:1898AnP...301..141S. doi:10.1002/andp.18983010512. (原始内容存档于2021-04-28) (德语). (modern citation: Annalen der Physik, vol. 301, pp. 141–151 (1898)).
- ^ 31.0 31.1 31.2 31.3 31.4 31.5 Seaborg 1968,第773页.
- ^ Fermi, Enrico. Artificial radioactivity produced by neutron bombardment: Nobel Lecture (PDF). Royal Swedish Academy of Sciences. 1938-12-12 [2013-07-23]. (原始内容存档 (PDF)于2018-08-09).
- ^ De Gregorio, A. A Historical Note About How the Property was Discovered that Hydrogenated Substances Increase the Radioactivity Induced by Neutrons. Nuovo Saggiatore. 2003, 19: 41–47. Bibcode:2003physics...9046D. arXiv:physics/0309046
 .
.
- ^ Nigro, M. Hahn, Meitner e la teoria della fissione (PDF). 2004 [2009-05-05]. (原始内容存档 (PDF)于2009-03-25).
- ^ van der Krogt, Peter. Elementymology & Elements Multidict. [2009-05-05]. (原始内容存档于2010-01-23).
- ^ Meitner, L. and Frisch, O. Disintegration of Uranium by Neutrons: a New Type of Nuclear Reaction. Nature. 1939, 143 (5218): 239–240 [2013-07-23]. Bibcode:1969Natur.224..466M. doi:10.1038/224466a0. (原始内容存档于2009-08-13).
- ^ Walsh, John. A Manhattan Project Postscript (PDF). Science (AAAS). 19, 212: 1369–1371 [2013-03-23]. ISSN 0036-8075. (原始内容 (PDF)存档于2013-06-29).
- ^ Helmreich, J.E. Gathering Rare Ores: The Diplomacy of Uranium Acquisition, 1943–1954, Princeton UP, 1986: ch. 10 ISBN 978-0-7837-9349-8
- ^ Reactors Designed by Argonne National Laboratory: Fast Reactor Technology. U.S. Department of Energy, Argonne National Laboratory. 2012 [2012-07-25]. (原始内容存档于2021-04-18).
- ^ History and Success of Argonne National Laboratory: Part 1. U.S. Department of Energy, Argonne National Laboratory. 1998 [2007-01-28]. (原始内容存档于2006-09-26).
- ^ Reactors Designed by Argonne National Laboratory: Light Water Reactor Technology Development. U.S. Department of Energy, Argonne National Laboratory. 2012 [2012-07-25]. (原始内容存档于2012-06-22).
- ^ STR (Submarine Thermal Reactor) in "Reactors Designed by Argonne National Laboratory: Light Water Reactor Technology Development". U.S. Department of Energy, Argonne National Laboratory. 2012 [2012-07-25]. (原始内容存档于2012-06-22).
- ^ 43.0 43.1 43.2 43.3 43.4 43.5 Emsley 2001,第480页.
- ^ Warneke, T.; Croudace, I. W.; Warwick, P. E. and Taylor, R. N. A new ground-level fallout record of uranium and plutonium isotopes for northern temperate latitudes. Earth and Planetary Science Letters. 2002, 203 (3–4): 1047–1057. Bibcode:2002E&PSL.203.1047W. doi:10.1016/S0012-821X(02)00930-5.
- ^ Newtan, Samuel Upton (2007). Nuclear War I and Other Major Nuclear Disasters of the 20th Century, AuthorHouse ISBN 978-1-4259-8512-7.
- ^ The Worst Nuclear Disasters. Time.com. 2009-03-25 [2010-05-24]. (原始内容存档于2013-08-26).
- ^ Gilliland, Frank D. MD; Hunt, William C. MS; Pardilla, Marla MSW, MPH; Key, Charles R. MD, PhD. Uranium Mining and Lung Cancer Among Navajo Men in New Mexico and Arizona, 1969 to 1993. Journal of Occupational & Environmental Medicine. March 2000, 42 (3): 278–283 [2013-07-23]. PMID 10738707. doi:10.1097/00043764-200003000-00008. (原始内容存档于2020-03-08).
- ^ 48.0 48.1 Brugge, Doug; Goble, Rob. The History of Uranium Mining and the Navajo People. American Journal of Public Health (Ajph.org). 2002, 92 (9): 1410–9. PMC 3222290
 . PMID 12197966. doi:10.2105/AJPH.92.9.1410.
. PMID 12197966. doi:10.2105/AJPH.92.9.1410.
- ^ Glaser, Alexander and von Hippel, Frank N. Thwarting Nuclear Terrorism. Scientific American. February 2006, 294 (2): 56–63 [2013-07-23]. PMID 16478027. doi:10.1038/scientificamerican0206-56. (原始内容存档于2013-12-03).
- ^ Seaborg 1968,第777页.
- ^ Uranium Enrichment. Argonne National Laboratory. [2007-02-11]. (原始内容存档于2007-01-24).
- ^ 52.0 52.1 Diehl, Peter. Depleted Uranium: a by-product of the Nuclear Chain. Laka Foundation. [2009-07-31]. (原始内容存档于2013-01-13).
- ^ Duarte, F. J. and Hillman, L. W. (编). Dye Laser Principles. Academic. 1990: 413. ISBN 0-12-222700-X. (原始内容存档于2010-09-17).
- ^ History/Origin of Chemicals. NASA. [2013-01-01]. (原始内容存档于2021-05-16).
- ^ Biever, Celeste. First measurements of Earth's core radioactivity. New Scientist. 2005-07-27 [2013-07-23]. (原始内容存档于2015-06-11).
- ^ Potassium-40 heats up Earth's core. physicsweb. 2003-05-07 [2007-01-14]. (原始内容存档于2012-01-13).
- ^ Min, M; Xu, H; Chen, J; Fayek, M. Evidence of uranium biomineralization in sandstone-hosted roll-front uranium deposits, northwestern China. Ore Geology Reviews. 2005, 26 (3–4): 198. doi:10.1016/j.oregeorev.2004.10.003.
- ^ Emsley 2001,第476 and 482页.
- ^ Macaskie, L. E.; Empson, R. M.; Cheetham, A. K.; Grey, C. P. and Skarnulis, A. J. Uranium bioaccumulation by a Citrobacter sp. as a result of enzymically mediated growth of polycrystalline HUO
2PO
4. Science. 1992, 257 (5071): 782–784. Bibcode:1992Sci...257..782M. PMID 1496397. doi:10.1126/science.1496397. - ^
Nilgiriwala, K.S.; Alahari, A.; Rao, A. S. and Apte, S.K. Cloning and Overexpression of Alkaline Phosphatase PhoK from Sphingomonas sp. Strain BSAR-1 for Bioprecipitation of Uranium from Alkaline Solutions. Applied and Environmental Microbiology. 2008, 74 (17): 5516–5523. PMC 2546639
 . PMID 18641147. doi:10.1128/AEM.00107-08.
. PMID 18641147. doi:10.1128/AEM.00107-08.
- ^ 61.0 61.1 World Uranium Mining. World Nuclear Association. [2010-06-11]. (原始内容存档于2018-12-26).
- ^ Seaborg 1968,第774页.
- ^ Athabasca Basin, Saskatchewan. [2009-09-04]. (原始内容存档于2010-06-12).
- ^ Gupta, C. K. and Mukherjee, T. K. Hydrometallurgy in extraction processes, Volume 1. CRC Press. 1990: 74–75. ISBN 0-8493-6804-9.
- ^ 65.0 65.1 65.2 Exploration drives uranium resources up 17%. World-nuclear-news.org. [2008-09-12]. (原始内容存档于2020-05-26).
- ^ 66.0 66.1 66.2 Global Uranium Resources to Meet Projected Demand. International Atomic Energy Agency. 2006 [2007-03-29]. (原始内容存档于2014-08-05).
- ^ Supply of Uranium. [2013-07-23]. (原始内容存档于2008-05-09).
- ^ Uranium Mining and Processing in South Australia. South Australian Chamber of Mines and Energy. 2002 [2007-01-14]. (原始内容存档于2012-01-06).
- ^ Military Warheads as a Source of Nuclear Fuel. World-nuclear.org. [2010-05-24]. (原始内容存档于2013-02-24).
- ^ 中科院海洋研究所. [2016-06-22]. (原始内容存档于2021-02-17).
- ^ Uranium recovery from Seawater. Japan Atomic Energy Research Institute. 1999-08-23 [2008-09-03]. (原始内容存档于2009-10-17).
- ^ How long will nuclear energy last?. 1996-02-12 [2007-03-29]. (原始内容存档于2007年4月10日).
- ^ Tsezos, M.; Noh, S. H. Extraction of uranium from sea water using biological origin adsorbents. The Canadian Journal of Chemical Engineering (Wiley-Blackwell). 1984, 62 (4): 559–561. ISSN 0008-4034. doi:10.1002/cjce.5450620416.
- ^ ORNL technology moves scientists closer to extracting uranium from seawater. Oak Ridge National Laboratory, United States. 2012-08-21 [2013-02-22]. (原始内容存档于2012-08-25).
- ^ PNNL: News – Fueling nuclear power with seawater. Pnnl.gov. 2012-08-21 [2013-02-22]. (原始内容存档于2012-08-25).
- ^ NUEXCO Exchange Value (Monthly Uranium Spot). (原始内容存档于12 十二月 2007).
- ^ Uranium Production. World Nuclear Association. [2013-07-21]. (原始内容存档于2016-01-23).
- ^ Lack of fuel may limit U.S. nuclear power expansion. Massachusetts Institute of Technology. 2007-03-21 [2007-03-29]. (原始内容存档于2013-11-05).
- ^ Deffeyes, Kenneth S. and MacGregor, Ian D. World Uranium Resources. Scientific American: 66. January 1980 [2008-04-21]. (原始内容存档于2013-07-28).
- ^ Nuclear Weapon Design. Federation of American Scientists. 1998 [2007-02-19]. (原始内容存档于2010-12-29).
- ^ Dial R for radioactive – 12 July 1997 – New Scientist. Newscientist.com. [2008-09-12]. (原始内容存档于2014-08-15).
- ^ Radiation Information for Uranium. U.S. Environmental Protection Agency. [2009-07-31]. (原始内容存档于2015-09-07).
- ^ ToxFAQ for Uranium. Agency for Toxic Substances and Disease Registry. September 1999 [2007-02-18]. (原始内容存档于2007-02-20).
- ^ 84.0 84.1 Craft, E. S.; Abu-Qare, A. W.; Flaherty, M. M.; Garofolo, M. C.; Rincavage, H. L. & Abou-Donia, M. B. Depleted and natural uranium: chemistry and toxicological effects (PDF). Journal of Toxicology and Environmental Health Part B: Critical Reviews. 2004, 7 (4): 297–317 [2019-12-25]. CiteSeerX 10.1.1.535.5247
 . PMID 15205046. doi:10.1080/10937400490452714. (原始内容存档 (PDF)于2011-07-23).
. PMID 15205046. doi:10.1080/10937400490452714. (原始内容存档 (PDF)于2011-07-23).
- ^ Toxicological Profile for Uranium (PDF). Atlanta, GA: Agency for Toxic Substances and Disease Registry (ATSDR). September 1999 [2013-07-23]. CAS# 7440-61-1. (原始内容存档 (PDF)于2011-09-27).
- ^ Hindin, Rita; Brugge, D.; Panikkar, B. Teratogenicity of depleted uranium aerosols: A review from an epidemiological perspective. Environ Health. 2005, 4: 17. PMC 1242351
 . PMID 16124873. doi:10.1186/1476-069X-4-17.
. PMID 16124873. doi:10.1186/1476-069X-4-17.
- ^ Arfsten, D.P.; K.R. Still; G.D. Ritchie. A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development. Toxicology and Industrial Health. 2001, 17 (5–10): 180–91. PMID 12539863. doi:10.1191/0748233701th111oa.
- ^ Domingo, J. L.; Paternain, J. L.; Llobet, J. M.; Corbella, J. The developmental toxicity of uranium in mice. Toxicology. 1989, 55 (1–2): 143–52. PMID 2711400. doi:10.1016/0300-483X(89)90181-9.
- ^ Public Health Statement for Uranium. CDC. [2007-02-15]. (原始内容存档于2021-02-08).
- ^ Chart of the Nuclides, US Atomic Energy Commission 1968
- ^ Dart, Richard C. Medical Toxicology. Lippincott Williams & Wilkins. 2004: 1468. ISBN 978-0-7817-2845-4.
- ^ 92.0 92.1 Radiation Fact Sheets #27, Uranium (U). Washington State Department of Health, Office of Radiation Protection. 2010 [2011-08-23]. (原始内容存档于2011-09-28).
- ^ Mulloy KB; James DS; Mohs K; Kornfeld M. Lung Cancer in a Nonsmoking Underground Uranium Miner. Environ Health Perspect. 2001, 109 (3): 305–309. PMC 1240251
 . PMID 11333194. doi:10.1289/ehp.01109305.
. PMID 11333194. doi:10.1289/ehp.01109305.
- ^ Samet JM; Kutvirt DM; Waxweiler RJ; Key CR. Uranium mining and lung cancer in Navajo men. N Engl J Med. 1984, 310 (23): 1481–1584. PMID 6717538. doi:10.1056/NEJM198406073102301.
- ^ Dawson, Susan E. Navajo Uranium Workers and the Effects of Occupational Illnesses: A Case Study (PDF). Human Organization. 1992, 51 (4): 389–397 [2019-12-25]. doi:10.17730/humo.51.4.e02484g513501t35. (原始内容存档 (PDF)于2013-07-19).
- ^ Gilliland FD; Hunt WC; Pardilla M; Key CR. Uranium Mining and Lung Cancer Among Navajo Men in New Mexico and Arizona, 1969 to 1993. J Occup Environ Med. 2000, 42 (3): 278–283. PMID 10738707. doi:10.1097/00043764-200003000-00008.
- ^ Gottlieb LS; Husen LA. Lung cancer among Navajo uranium miners. Chest. 1982, 81 (4): 449–52. PMID 6279361. doi:10.1378/chest.81.4.449.
书籍
[编辑]- Emsley, John. Uranium. Nature's Building Blocks: An A to Z Guide to the Elements. Oxford: Oxford University Press. 2001: 476–482. ISBN 0-19-850340-7.
- Seaborg, Glenn T. Uranium. The Encyclopedia of the Chemical Elements. Skokie, Illinois: Reinhold Book Corporation. 1968: 773–786. LCCCN 68-29938.
外部链接
[编辑]- 元素铀在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 铀(英文)
- 元素铀在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素铀在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 铀(英文)
- 美国能源部有关铀辐射的资料 (页面存档备份,存于互联网档案馆)
- 世界原子能协会:“铀是什么?” (页面存档备份,存于互联网档案馆)
- 铀目前的市场价格 (页面存档备份,存于互联网档案馆)
- 全球铀矿藏地图
- 美国国家医学图书馆有害物质数据库——铀 (页面存档备份,存于互联网档案馆)
- Uranium (页面存档备份,存于互联网档案馆) at The Periodic Table of Videos (University of Nottingham)








